二氧化碳水合物相平衡研究毕业论文
2020-07-02 22:52:26
摘 要
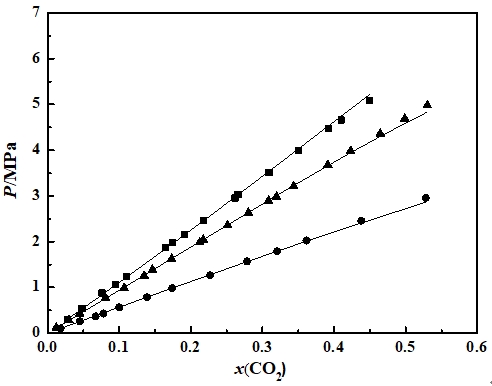
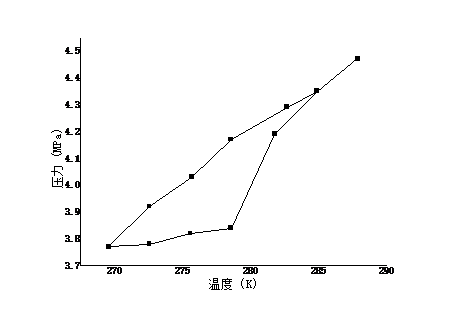
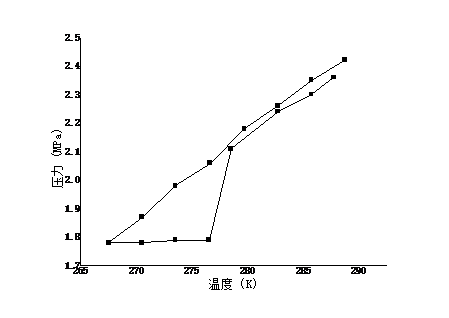
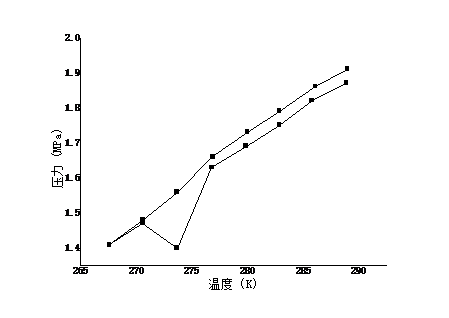
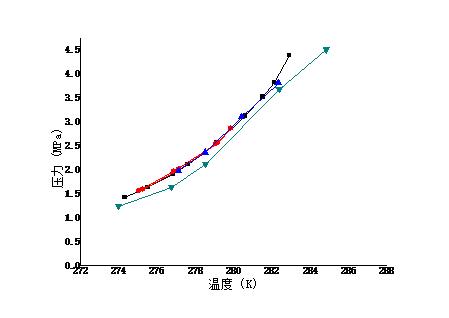
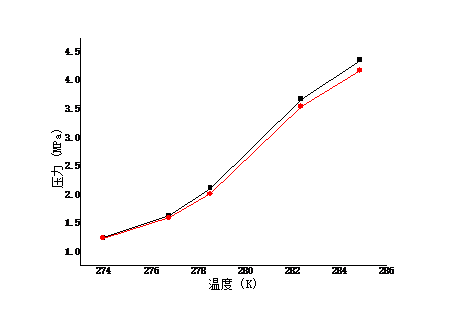
近年来,全球变暖愈演愈烈,如何通过资源化利用的方式来消减二氧化碳 气体排放,实现环境保护和资源利用的双赢,已经成为当今国际社会关注的共同焦点。水合物作为一种自然界特殊的化合物,具有某些特殊的性质,比如天然气水合物热值高,是一种优秀的未来能源。近来科学家发现水合物能够高效存储二氧化碳。本文在前人研究的基础上,采用实验与计算模型相结合的方法,测定了二氧化碳与水在273.95K至284.85K下的相平衡数据,系统研究了1.24MPa至4.35MPa压力条件下水和二氧化碳的相行为,对水合物的开发及利用提供了重要的理论指导。结果表明, 二氧化碳与水低温水合物的相平衡点随温度和压力的升高而升高。通过RK方程、SRK方程和PR方程的计算,对相平衡点进行了预测,结果表明,计算值与实验值吻合良好,误差在-8.946%范围之内。
Study on phase equilibrium of carbon dioxide hydrate
ABSTRACT
In recent years, global warming has intensified. How to reduce carbon dioxide emissions through resource utilization and achieve a win-win result in environmental protection and resource utilization has become a common concern of the international community today. As a special compound in nature, hydrates have certain special properties. For example, natural gas hydrate has a high calorific value and is an excellent future energy source. Recently scientists have discovered that hydrates can efficiently store carbon dioxide. On the basis of previous studies, the experimental and computational models were used to determine the phase equilibrium data for carbon dioxide and water at 273.95K to 284.85K. Systems of water and carbon dioxide at pressures of 1.24MPa to 4.35MPa were systematically studied. Phase behavior provides important theoretical guidance for the development and utilization of hydrates. The results show that the equilibrium point of carbon dioxide and water low temperature hydrate increases with temperature and pressure. Based on the calculations of RK equation, SRK equation and PR equation, the phase equilibrium point is predicted. The results show that the calculated values agree well with the experimental values, and the error is in the range of -8.946%.
目录
摘要 I
ABSTRACT II
第一章引言 1
1.1相平衡测定的意义 1
1.2水合物相平衡研究现状 1
1.2.1水合物简介 1
1.2.2水合物的利用 2
1.2.3水合物相平衡测定方法 4
1.3研究目的和意义 6
第二章相平衡数据的测定 7
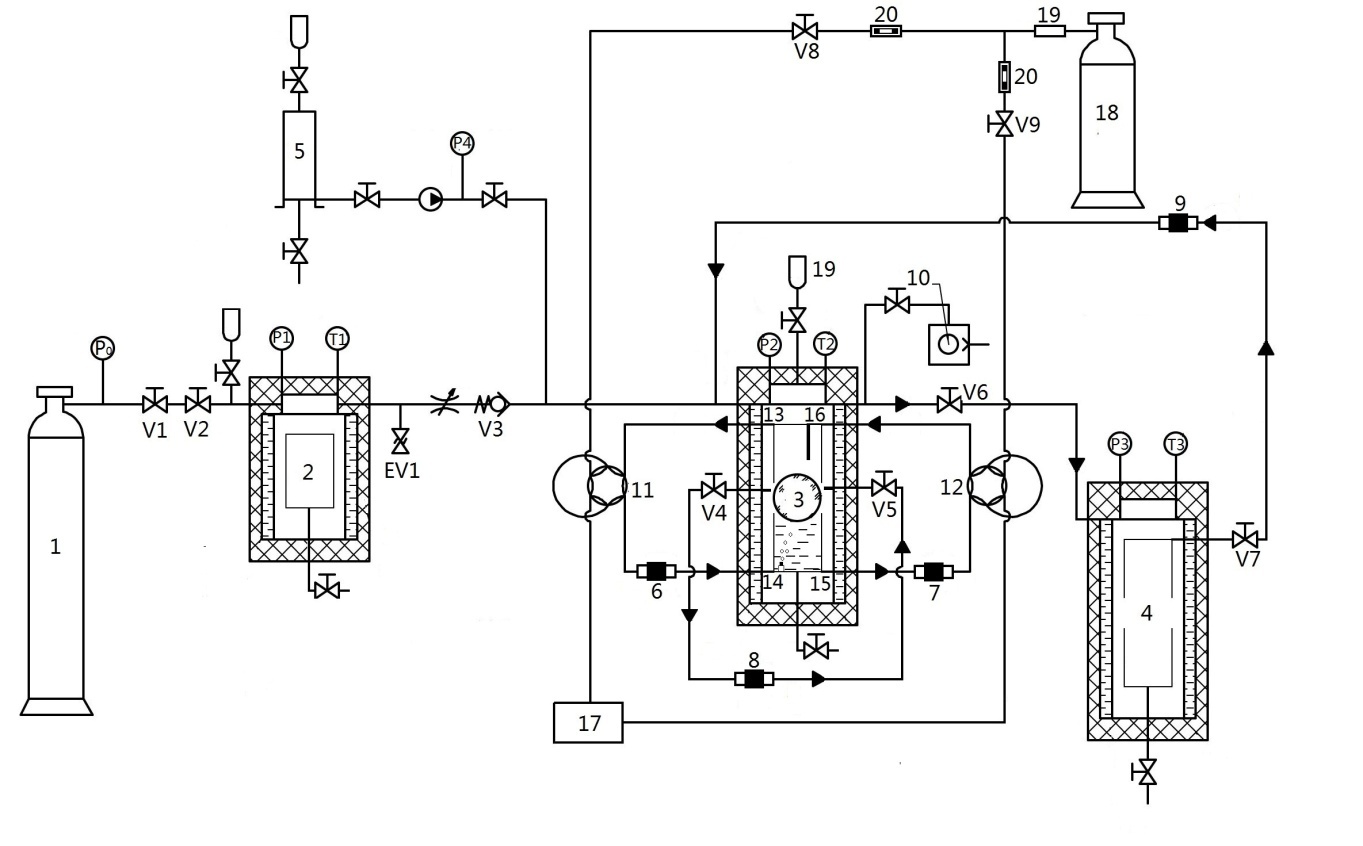
2.1实验设备 7
2.2实验装置的可靠性验证 7
2.3主要实验原料 8
2.4实验步骤 8
2.5数据处理 9
2.6本章小结 14
第三章水合物状态方程 16
3.1状态方程的意义 16
3.1van der Waals状态方程 16
3.2Redlich-Kwong(RK) 方程 16
3.3 Soave-Redlich-Kwong方程 17
3.3 Peng-Robinson方程 17
3.4状态方程的应用 19
3.5本章小结 25
第四章结论 26
参考文献 27
致谢 29
第一章引言
1.1相平衡测定的意义
当两种相态的物质接触时,它们会互相交换他们的成分直到这两个相态的组成维持不变。但是在微观中,组分的交换并不是静止的,只是他们的交换速率相等,所以这两相的组分保持不变。多相体系相平衡的研究在化学、化工的科研和生产中有重要的应用,例如溶解、分馏、重结晶、萃取、提纯及金相分析等方面都要用到相平衡的相关数据。[1]一方面,石油工业在天然气输送过程中遇到了与水合物形成有关的经济和技术问题,另一方面,天然气储存和分离等广阔的优势显示了水合物有利的一面。而且,地质学家估测有大量的以天然气水合物的形式被困在深海和冻土的能源,这样的储备开发可以减轻未来的能源危机。而且全球气候变暖已经成为我们面临的严峻考验,温室气体二氧化碳的捕集、埋存和资源化利用等方面密切地与相平衡问题相关,水合物是一种安全的气体储存形式,特别是对二氧化碳等环境有害气体的储存。
1.2水合物相平衡研究现状
1.2.1水合物简介
水合物是一种含水的化合物,它是由气体分子被水分子通过氢键构成的多面体笼型结构包围在其中形成的。它是一种晶状固体,通过低分子量气体和水分子的接触,在高压和低温下自发形成。
根据热力学条件,气体形成不同的笼形结构,即SI、SII和SH;各有不同的形状和大小的笼子里,这些笼子俗称笼状物,气体分子被包裹在笼子里即笼状物中并且稳定的存在。形成水合物所需的外界条件一般就是压力和温度。自然界中水合物大多在深海大陆架,或者冻土层中,我们见过的可燃冰就是其中的一种。
气体水合物的发现和探索历史悠久,最早起源于19世纪初,当时是实验过程中机缘巧合发现的,化学家Davy在平时日程实验过程中偶然的看见,Cl2在温度较高的零上温度仍然可以凝固,这个温度高于Cl2的凝固点,其实这就是Cl2在低温和一定压力条件下形成的Cl2水合物。一次偶然的机会,Hammer
相关图片展示: