骨修复材料CPC对玻璃离子水门汀性能的影响毕业论文
2020-02-19 15:38:01
摘 要
玻璃离子水门汀(GIC)作为齿科修复材料广泛应用于临床口腔,有望替代银汞合金和复合树脂成为永久性充填材料,作为生物种植材料也有应用前景。然而GIC中磷和钙元素含量不高,生物活性较低,这很大程度限制其在生物医用材料上的应用。本实验将不同含量的TTCP/DCPA掺入玻璃离子水门汀的粉剂中,研究其对玻璃离子水门汀性能的影响以及确定TTCP/DCPA的最佳掺量。
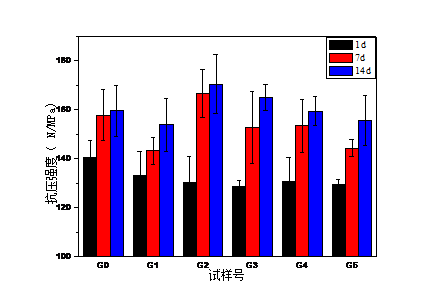
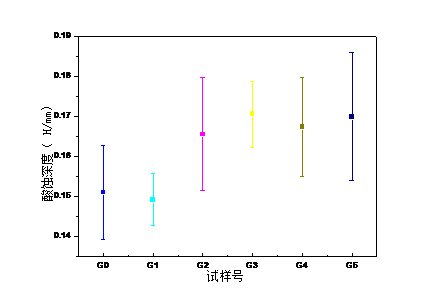
随着玻璃粉剂中TTCP/DCPA含量增多,GIC固化时间也随之延长;GIC(3wt%-13wt%)的1d抗压强度均低于对照组G0,但均达到国际标准100MPa;GIC中掺入少量的TTCP/DCPA(3wt%-7wt%),GIC耐磨性能得到改善,掺入量过大,GIC耐磨性降低;掺入TTCP/DCPA(3wt%-13wt%)减弱了GIC的耐酸性能,但酸蚀深度仍满足临床要求小于0. 17mm。因此,综合各项性能,TTCP/DCPA的最佳掺量为7wt%。
关键词:玻璃离子水门汀;骨修复材料TTCP/DCPA;耐磨性
Abstract
As a dental restoration material, glass ionomer cement (GIC) is widely used in clinical oral cavity. It is expected to replace amalgam and composite resin as permanent filling materials, and it has application prospects as bio-planting materials. However, the content of phosphorus and calcium in GIC is not high and the biological activity is low, which greatly limits its application in biomedical materials. In this experiment, different amounts of TTCP/DCPA were incorporated into the powder of glass ionomer cement to study its effect on the performance of glass ionomer cement and determine the optimal dosage of TTCP/DCPA.
With the increase of TTCP/DCPA content in the glass powder, the GIC curing time also prolonged; the 1d compressive strength of GIC (3wt%-13wt%) was lower than that of the control group G0, but both reached the international standard 100MPa; A small amount of TTCP/DCPA (3wt%-7wt%), GIC wear resistance is improved, the amount of incorporation is too large, GIC wear resistance is reduced; the incorporation of TTCP/DCPA (3wt%-13wt%) weakens the acid resistance of GIC 17毫米。 However, the depth of the acid etching is still less than 0. 17mm. Therefore, in combination with each performance, the optimum amount of TTCP/DCPA is 7 wt%.
Key Words:glass ionomer cement; bone repair material TTCP/DCPA; wear resistance
目录
第1章 绪论 1
1.1玻璃离子水门汀 1
1.1.1GIC粉剂的组成 1
1.1.2 GIC的固化反应过程 2
1.1.3 GIC结构及其性能 3
1.2骨修复材料(CPC)的研究和应用 4
1.3掺杂型玻璃离子水门汀 4
1.3.1掺杂型GIC的研究现状 5
1.3.2掺杂型GIC的研究趋势 6
1.4论文选题的目的、意义和内容 6
1.4.1选题的目的和意义 6
1.4.2研究内容 7
第2章 实验过程 8
2.1实验方案、设备和原料 8
2.1.2实验设备 8
2.1.3 实验原料 9
2.2 玻璃离子水门汀的制备 9
2.2.1GIC粉剂的制备 9
2.2.2 GIC粉体的组成 10
2.2.2玻璃离子水门汀的制备 10
2.3性能测试实验 11
2.3.1固化时间测试 11
2.3.2抗压强度测试 12
2.3.3耐磨性测试 13
2.4结构表征实验 14
2.4.2扫描电镜分析(SEM) 14
2.4.3傅里叶变换红外光谱分析 15
第3章 实验数据 16
3.1固化时间 16
3.2抗压强度 16
3.3耐磨性能 17
3.4耐磨性能 18
3.5 TTCP表征和GIC微观测试分析 19
3.5.3扫描电镜分析 21
第4章 结论和展望 23
4.1结论 23
4.2展望 23
致谢 25
参考文献 26
第1章 绪论
玻璃离子水门汀(GIC)作为传统的口腔修复材料已在口腔临床中应用很长的时间。玻璃离子水门汀是一类新型的牙科水门汀,自1972年进入欧洲市场后,由于它具有氟离子释放、半透明性、粘结性好以及对牙体的刺激性弱等优良的综合性能,因此得到了非常迅速的发展,它是目前口腔临床中非常重要的修复材料之一,被广泛应用于各种牙体修复、衬底以及齿科粘结,它也是目前龋齿非创伤性充填修复治疗的最为理想的修复材料,作为种植材料也具有非常好的前景,因此自问世以来得到了相关学者的广泛关注和研究。
1.1玻璃离子水门汀
1.1.1GIC粉剂的组成
玻璃离子水门汀是由粉剂和液剂按照一定的比例调拌均匀,发生固化反应后形成以聚羧酸盐为基体的固相复合材料。玻璃离子水门汀的液剂的主要成分为聚羧酸或者聚羧酸与小分子酸(如酒石酸等)的混合酸,其中酒石酸可用来提高水门汀可操作性。酒石酸可作为反应控制剂,抑制聚羧酸钙的形成,从而延长玻璃离子水门汀的反应时间,提高临床的可操作时间;另一方面,根据以往学者的研究,酒石酸还可以加速GIC固化反应后期聚羧酸铝的形成。这是由于在较高PH值下,能够形成聚羧酸盐,而在低PH值下,酒石酸能够先与玻璃离子发生反应,抑制聚羧酸钙的形成,这样也就有效的延长了可操作性时间[2]。而GIC粉剂主要是氟铝硅酸盐玻璃研磨而成的玻璃粉。氟铝硅酸盐玻璃粉剂和聚羧酸液剂进行酸碱中和反应固化形成玻璃离子水门汀,该固化反应机理为:氟铝硅酸盐玻璃粉中含有Al-O-Si基团,在聚羧酸的侵蚀作用下,玻璃粉中的阳离子(Ca2 、Al3 )从玻璃结构中游离出,并且与聚羧酸根结合形成稳定的聚羧酸盐,构成玻璃离子水门汀的基体结构,剩余的是硅凝胶以及未反应完全的玻璃粉,因此玻璃粉的成分对玻璃离子水门汀的性能有着非常重要的影响 [3] 。
影响玻璃离子水门汀性能的因素有很多,如玻璃粉的组成和结构,调拌的时间和手法等等,其中玻璃结构中阳离子含量也是影响玻璃离子水门汀性能的重要因素。玻璃离子水门汀之所以能够形成的关键就在于玻璃结构中存在Al-O-Si基团,在发生固化反应时,低价阳离子(Ca2 、Na )会首先从玻璃结构中游离出来并与聚羧酸形成线性的聚羧酸盐结构,此时具有粘弹性,后期主要由Al3 从玻璃结构中游离出来与聚羧酸形成三维网状的聚羧酸盐结构,交连程度变大,此时粘度变得更大,强度变得更高。[1]因而Al/Si以及Ca2 和Na 的含量都会影响玻璃离子水门汀的结构和性能。当Al/Si比较小时,玻璃结构中形成Si-O-Al的结构少,不易于玻璃离子水门汀的形成,适当提高Al含量增强GIC中的聚羧酸盐的交联程度,有利于强度的提高;而当Al/Si较大时,不仅提高了烧结温度,SiO2含量减少也会造成形成玻璃困难。[5]另外,Ca2 或者Na 在固化反应初期游离出来参与反应,半径较小且电荷强度小,容易从玻璃结构中溶出,从而会加快GIC的固化反应。[5]然而考虑到玻璃离子水门汀的水解速度和固化反应时间不宜过快的要求,一般需要控制这些小半径阳离子的含量。
玻璃离子水门汀如今广泛应用于口腔临床治疗,并且对其性能的要求也越来越高,为了改善玻璃离子水门汀的一些性能,比如固化时间、强度、耐磨性和耐酸性等,近几年的研究学者也在不断探索不同玻璃结构组成的GIC的性能。[4]有学者以La替代玻璃体系中的Al离子,探究不同La/Al对GIC性能的影响。[6]也有学者在玻璃粉中掺TiO2,探索玻璃离子水门汀的性能改变。[7]此外,一些研究学者在玻璃组分中添加成核剂,期望得到玻璃离子水门汀的微晶玻璃粉,通过调节玻璃的结构来控制玻璃粉剂的反应速度以及提高CIC的强度。[10]
1.1.2 GIC的固化反应过程
氟铝硅酸盐玻璃中含有大量的Al-O-Si基团,这种结构很容易被酸侵蚀使其中的Al3 从玻璃结构中游离出来与聚羧酸形成聚羧酸盐。氟铝硅酸盐玻璃能否形成玻璃离子水门汀以及其结构强度如何,主要还取决于Al/Si比。当Al/Si比较小时,玻璃结构中形成Si-O-Al的结构少,不易于玻璃离子水门汀的形成;而当Al/Si较大时,不仅提高了烧结温度,SiO2含量减少也会造成形成玻璃困难。[8]
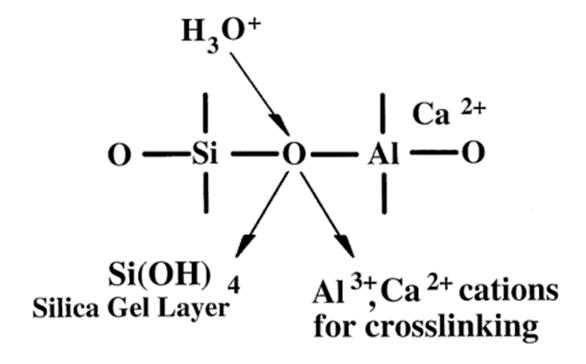
图1.1 GIC结构中酸解Si-O-Al基团的过程
玻璃离子水门汀的形成主要包括以下过程:首先,聚羧酸与玻璃粉表面颗粒反应,玻璃粉表面受到侵蚀后,其中的阳离子(Ca2 、Na 和Al3 等)从玻璃结构中游离出来,并且在玻璃表面形成一层硅凝胶(如图1.2);其次,随着阳离子的不断游离,聚羧酸不断反应,液相的PH值不断升高,Ca2 、Na 首先游离出并与聚羧酸根结合形成线性的聚羧酸盐,这就形成了玻璃离子水门汀早期的凝胶结构,具有粘弹性;后期Al3 的游离形成三维网状的聚羧酸盐结构,随着网络交连结构的进一步复杂,玻璃离子水门汀结构逐步形成并硬化,未反应完的玻璃粉颗粒被包裹在聚羧酸盐中。[9]固化反应一直持续进行,其中少量的Si4 和PO43 也会进入聚羧酸盐基质中,由于其配位数高,会与聚羧酸盐一起形成有机无机交互的三维网络结构,使得交连程度更复杂,强度更高。因而在24h后,玻璃离子水门汀的强度还会有持续的提高 [11]。
玻璃离子水门汀的固化反应过程是一个复杂的、持续的过程。首先,早期的低价阳离子(Ca2 、Na )从玻璃结构中游离出来与聚丙烯酸结合形成早起的凝胶结构,后期高价阳离子Al3 游离出来与聚丙烯酸结合形成聚羧酸盐结构,成为玻璃离子水门汀的基体,强化玻璃离子水门汀的结构,同时还有更高价的Si4 和P5 也有少部分从玻璃结构中游离出来,虽然含量较少,但对后期玻璃离子水门汀强度的增强也有一定的作用,使得后期玻璃离子水门汀的强度 硬度变得更大。[20]
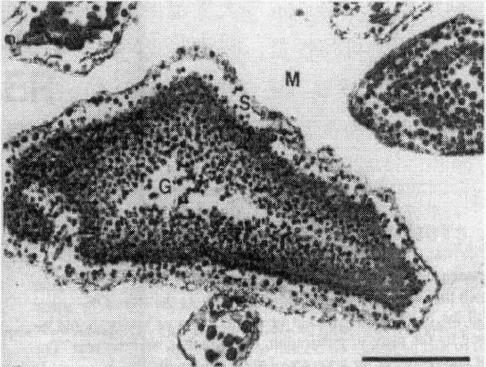
图1.2玻璃离子水门汀透射电镜图
1.1.3 GIC结构及其性能
玻璃离子水门汀从结构上看是一种复合材料结构。[10]在固化反应过程中,阳离子从玻璃结构中游离出来与聚羧酸结合形成的聚羧酸盐成为玻璃离子水门汀的基体,未参与反应的玻璃粉颗粒成为增强体填料,玻璃颗粒表面析出Ca2 和Al3 后剩余部分形成的硅凝胶成为玻璃离子水门汀的界面,这就构成了玻璃离子水门汀固相复合材料的结构,玻璃离子水门汀透射电镜图如图1.2所示。[21]玻璃离子水门汀作为一种目前研究和应用非常广泛的医用材料,在临床应用上有着许多的特殊的优异性能,主要包括有:粘结性好,能在玻璃离子水门汀和牙体之间形成良好的化学结合;动态的氟离子释放,能抑制牙体组织脱矿以及促进其再矿化;有着与牙体组织接近的热胀系数,容易形成良好的边缘封闭;对牙髓刺激性低、操作简便以及色泽美观,与牙体颜色相近等优异性能[13]。玻璃离子水门汀作为一种医用修复材料,对其在强度和固化时间等其他方面性能上也有着较高的要求。首先,玻璃离子水门汀的固化时间不能过快或过慢,固化时间过短,还未来得及调拌均匀就已固化,不利于口腔临床应用;固化时间过慢,在实际补牙过程中十分不方便,对固化后的性能也有影响,也不利于口腔临床应用,因此临床研究需要适当的固化时间;玻璃离子水门汀作为一种牙科修复材料,需要满足咀嚼食物以及各种口腔环境的要求,因此需要玻璃离子水门汀具有一定的强度和耐磨性以及耐酸性,能够适应长期在口腔中的环境,因此玻璃离子水门汀的强度、耐磨性能和耐酸性能指标都是需要考虑的。[14]作为玻璃离子水门汀结构的三种组成部分,其对玻璃离子水门汀性能有着非常大的影响,其中硅凝胶和聚羧酸盐基质尤为重要,因此要改善玻璃离子水门汀的性能,可从改善其硅凝胶和聚羧酸盐基质二者上下功夫[14]。
1.2骨修复材料(CPC)的研究和应用
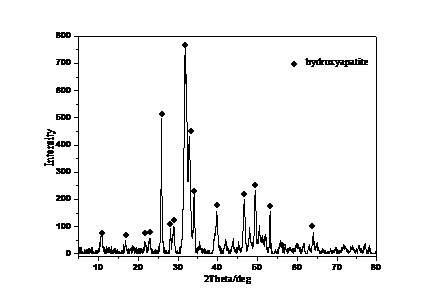
磷酸钙水门汀(CPC)是一种骨修复材料,1986年,Brown和Chow首次研制出自凝磷酸钙水门汀,主要成分是由磷酸四钙(TTCP)和无水磷酸氢钙(DCPA)。磷酸四钙(TTCP)和无水磷酸氢钙(DCPA)二者经水化会生成的羟基磷灰石即为磷酸钙水门汀的主要成分,水化产物羟基磷灰石成分与人体骨组织十分相近,具有与牙体很好的生物相容性以及生物活性,是一种广泛运用的医药材料,但由于磷酸钙水门汀强度不够高的原因,一般应用在无强度承载的骨修复部分。[32]
1.3掺杂型玻璃离子水门汀
随着玻璃离子水门汀在口腔临床上的广泛应用,对其性能的要求也日益提高,因而不少专家学者都对如何改善玻璃离子水门汀性能进行研究。近些年,广大专家学者们都有试图通过改变玻璃粉的组成,或者向玻璃粉剂中添加成分的方法来改善玻璃离子水门汀的性能。比较常见的有:在玻璃粉剂中添加金属氧化物,或者在玻璃粉剂中添加玻璃纤维或植物纤维等等,通过向玻璃粉剂中添加组分形成掺杂型玻璃离子水门汀,从而改善GIC的各项性能。[15-18]
1.3.1掺杂型GIC的研究现状
由于玻璃离子水门汀具有比其它水门汀更优异的性能,因此广泛用于口腔临床治疗研究中。但研究学者们在临床应用时发现,玻璃离子水门汀质地较脆,机械性能比较差,强度不够高以及耐磨性不够好等缺点,这些问题很大的限制了玻璃离子水门汀在医用上的应用和发展。[21]玻璃离子水门汀需要长期适应在人体口腔内的环境,并且需要满足人们咀嚼食物的强度和耐磨性要求,为了使玻璃离子水门汀能适应各种口腔环境,应用更加广泛,不少专家学者开始致力于添加成分对玻璃离子水门汀的改性。[23]
1977年,有学者通过将银汞合金加入到玻璃离子水门汀中以求改善玻璃离子水门汀的机械强度,[30]在加入金属增强方向上,还有学者加入了金、钛、钡等金属,[27]结果发现玻璃离子水门汀的机械强度和耐磨性均有所提高,但这些改良后的复合材料很难抛光,而且容易变色,美学效果很差。学者Shahid S等[28]将Sr元素加入到玻璃离子水门汀中以部分或全部替换玻璃组分中的Ca元素,研究了GIC的氟释放性能、辐射性和生物活性,发现Sr2 的存在不仅延长固化了时间,同时提高了玻璃离子水门汀的机械强度,并且在细胞相容性上也有所改善。
1980年,有学者开始研究用树脂改性玻璃离子水门汀,结果发现树脂改性的确能提高玻璃离子水门汀的机械性能,还能降低玻璃离子水门汀的溶解性,但是树脂的存在使得玻璃离子水门汀的生物相容性降低了,氟离子释放下降,对牙髓刺激性也变高了,而且还会影响该复合型水门汀与牙体组织的粘结。[26]
有Poosti等[24-25]研究表明,加入纳米TiO2到玻璃离子水门汀中能够在不改变玻璃离子水门汀的物理性能情况下增强它的抗菌性,于是更多的学者致力于用纳米TiO2改性。刘莉霞等人[22]在传统的玻璃离子水门汀中加入了不同质量分数的纳米TiO2颗粒,发现纳米TiO2颗粒的加入显著增强了玻璃离子水门汀的机械性能,而且在抗菌性方面也得到了改善,同时也没有影响玻璃离子水门汀的氟离子释放等物理性能。
羟基磷灰石的组成和结构与人体骨组织成分相似,因此具有较好的生物学行为,加入羟基磷灰石到玻璃离子水门汀中改性,能够改善复合型水门汀与牙体组织的生物相容性。[29]Gu等人研究发现,加入羟基磷灰石改性,不仅能提高玻璃离子水门汀的机械性能,同时也不会影响氟离子的释放,能够增强玻璃离子水门汀的微结构。[19]
还有许多的研究,如在玻璃离子水门汀中加入氧化锆,硫酸钡,生物活性玻璃纤维以及不锈钢粉末等等,[30-35]这些研究都是为了改善玻璃离子水门汀的物理性能和机械强度,以使得玻璃离子水门汀能够更加应用更加广泛。
1.3.2掺杂型GIC的研究趋势
如今,玻璃离子水门汀的研究十分活跃,作为一种医用口腔材料,在粉剂组成、液剂组成、以及固化方式和制备工艺方面得到了很大的改进。[23]在保证其具有一定粘结性能的条件下,改善力学性能、生物活性以及氟离子释放等等,使其成为替代复合树脂和银汞合金的长期性填充材料,是如今医用材料的一大研究方向。[26]
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: