CoMo双金属基纳米结构的构筑及电催化析氢析氧性能研究毕业论文
2020-02-19 15:50:13
摘 要
随着世界人口的不断增长,对可持续能源的需求日益增加,能源危机和环境污染问题日益严重。为此,需要研究开发可代替传统化石能源的可再生清洁能源。氢气由于其热值高、燃烧性能好、无毒无污染等特点,被认为是最具有前景的新型清洁能源。人们制备氢气的方法有很多种,而目前被认为是最有价值的、最有前景的就是通过电解水制备氢气,这是因为电解水只产生氢气和氧气,没有其他有害的副产物。而影响电解水制氢中最关键的技术就是催化剂,催化剂的种类有很多,而最高效的催化剂还是得依赖于铂、铱等贵金属,但其高成本、资源短缺等问题严重阻碍了它们的大规模商业化应用。所以开发新型低成本、高效的非贵金属催化剂是当前研究的热点。钴、钼过渡金属元素不仅在地球上的储量多,还具有低成本、高的电导率等优点,在电解水上得到越来越多的关注。
基于此,本论文主要对Co/Mo双金属基纳米结构电催化剂材料的设计构筑、制备表征、电化学性能测试进行了系统的研究,结论总结如下:
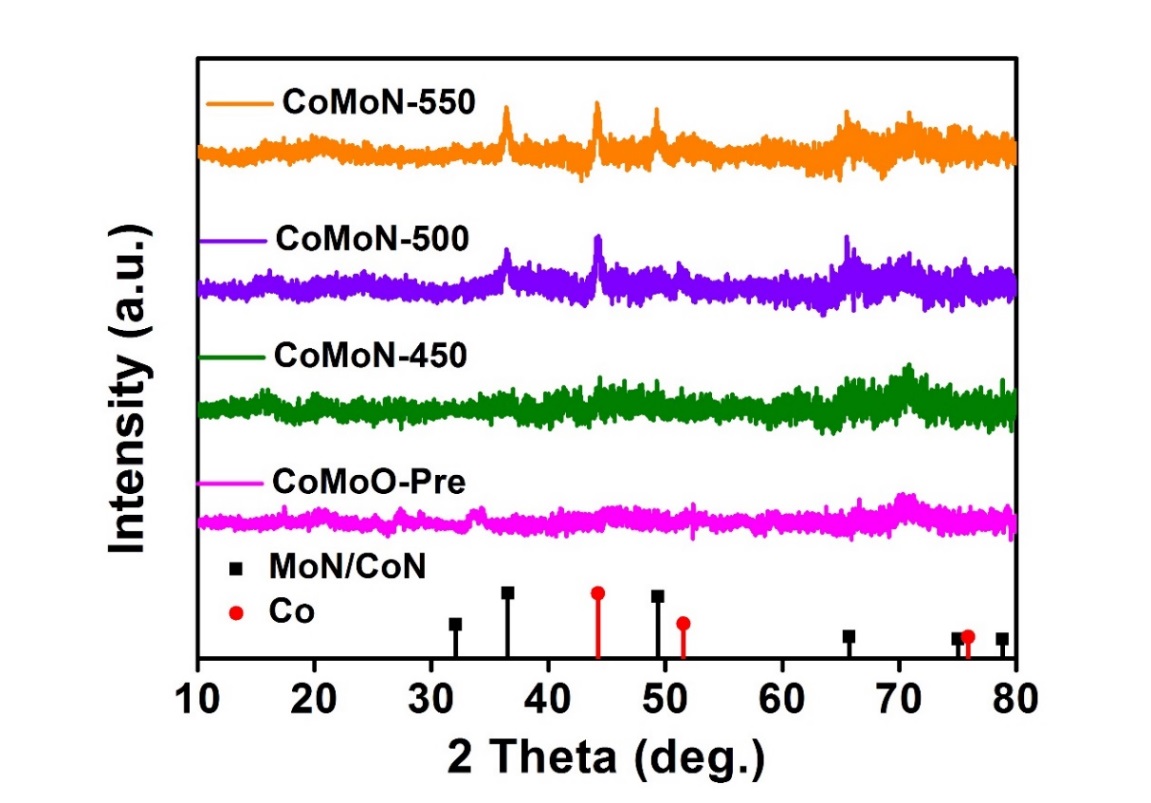
- 通过水热法可控制备CoMoO前驱体,结合后期在不同温度环境下的氮化过程,得到基于温度梯度不同的CoMoN化合物:CoMoN-450、CoMoN-500、CoMoN-550。
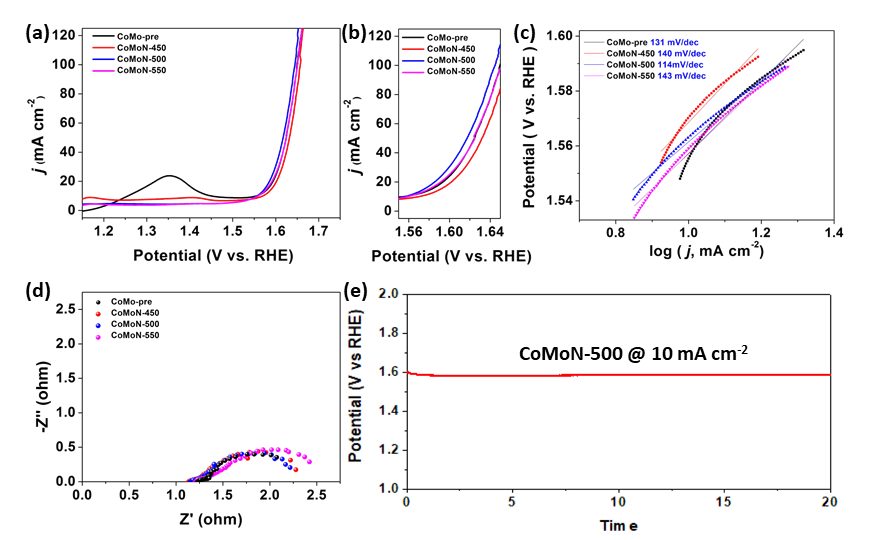
- 在1 M KOH 溶液中进行电催化性能测试。可以看出,在20 mA cm-2的电流密度下,CoMoN-500具有最小的过电势1.585 V,以及最小的塔菲尔斜率114 mV dec-1,说明CoMoN-500具有最好的OER催化性能。
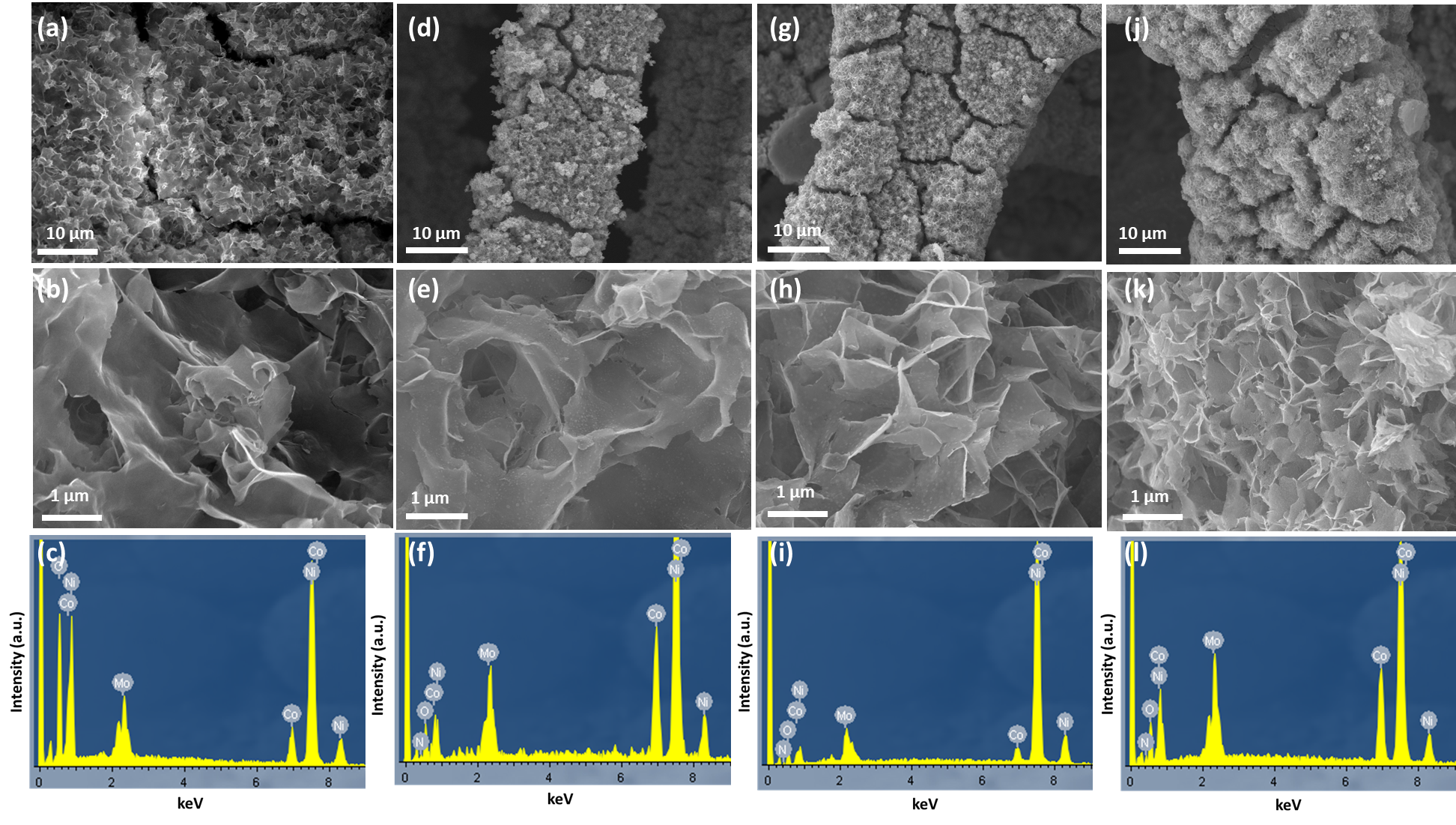
- CoMoN良好的OER电催化活性可归结于材料的微观形貌,片状结构具有较大的比表面积,暴露出更多的活性位点,从而提升OER活性。此外,双金属的协同作用以及Co单质对材料导电能力的增强效果在电催化过程中也发挥了重要的作用。
关键词:电催化;析氧反应; Co/Mo基双金属催化剂;氮化物;纳米结构构筑
Abstract
With the growth of the world population, the demand for sustainable energy is increasing sharply and the energy depletions and environment pollution is increasingly serious. It is necessary to explore renewable clean energy sources to replace traditional fossil fuels. Hydrogen energy is considered as the most promising new green clean energy due to its high calorific value, good combustion performance, non-toxic and no pollution. There are many ways to prepare hydrogen, and what is currently considered to be the most valuable is to produce hydrogen from electrolyzed water because electrolyzed water produces only hydrogen and oxygen, and no other harmful by-products. The most important technology affecting the production of hydrogen from electrolyzed water is the catalyst. There are many kinds of catalysts, and the most efficient catalyst still depends on precious metals such as platinum and rhodium. However, the practical application of these precious metal based electrocatalysts has been greatly restricted by their high cost and scarcity. Therefore, the development of new low-cost, high-efficiency non-precious metal catalysts is a hot topic of current research. Cobalt and Molybdenum have attracted lots of interest in water splitting, because of its high storage, economical to manufacture and high conductivity.
Here, we synthesize Co/Mo bimetallic nano-structure electrocatalyst, the preparation, characterization and electrochemical performance have been investigated. Our results are listed as follows:
- The CoMoO precursor was synthesized by hydrothermal method, and the precursor was nitrided under different temperature conditions to obtain different CoMoN compounds: CoMoN-450, CoMoN-500 and CoMoN-550.
- The electrocatalytic performance is tested in 1 M KOH solution. CoMoN-500 has a minimum overpotential of 1.585 V at a current density of 20 mA cm-2 with a minimum Tafel slope of 114 mV dec-1, indicating that CoMoN-500 has the best OER catalytic performance. .
- The good OER electrocatalytic activity of CoMoN can be attributed to the microscopic morphology of the material. The flaky structure has a large specific surface area and exposes more active sites which enhance the OER activity. In addition, the synergistic effect of bimetals and the enhancement of the conductivity of Co on the material's conductivity also play an important role in the OER process.
Key Words: Electrolysis; Oxygen Evolution Reaction; Co/Mo Based Bimetallic Catalysts; Nitrides; Construction of Nanostructures
目 录
摘 要 I
Abstract II
第1章 绪论 1
1.1 引言 1
1.2 电催化分解水 2
1.2.1 电解水简介 2
1.2.2 电解水原理 3
1.3 电催化剂 4
1.3.1 电催化剂活性参数 4
1.3.2 析氢催化剂 5
1.3.3 析氧催化剂 6
1.4 本论文选题意义及主要研究内容 7
第2章 实验材料的制备与表征 9
2.1 实验药品和仪器 9
2.1.1 实验药品 9
2.1.2 实验仪器 9
2.2 材料的表征方法 10
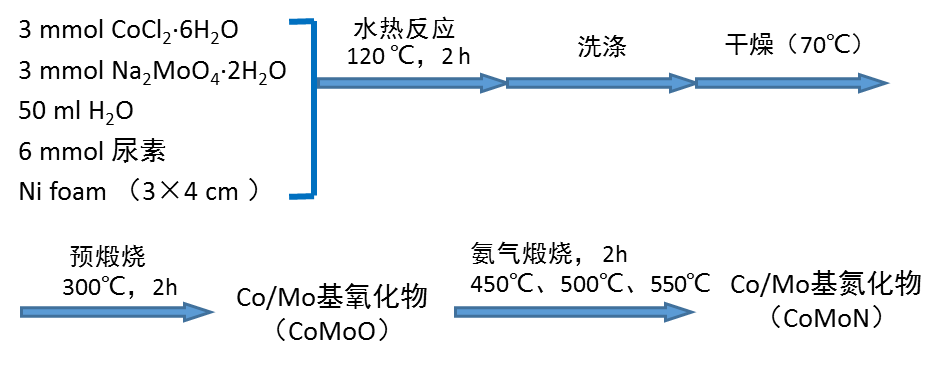
2.3 CoMoN的制备与表征 10
2.3.1 CoMoN的制备 10
2.3.2 CoMoN的表征 11
第3章 CoMoN的电化学性能测试及机理分析 14
3.1 CoMoN的电化学性能测试 14
3.2 电催化机理分析 16
第4章 结论与展望 17
参考文献 18
致谢 21
第1章 绪论
1.1 引言
能源是人类赖以生存的重要基础,是推动国民经济和社会发展的动力。随着科技的进步以及人类社会的不断发展,人们对能源的需求量也越来越大,随之而来的环境污染与能源危机问题也日益严重。化学能源作为一种不可再生能源,储量十分有限,急需替代品。可再生绿色清洁能源的开发为上述问题提供了行之有效的解决方法,对改善环境以及人类发展需求都具有很大的意义。
众所周知,人类已经开发利用了很多种清洁能源,如太阳能、风能等,它们在一定程度上缓解了人们对传统化石能源的依赖。但是很多可再生清洁能源的供应存在不稳定性、间歇性等问题,这些问题使得它们的开发利用大大受限,例如风能,往往需要在地势较高出建立风力发电机,设备的安装和运输都存在着极大的不便;又如太阳能,目前的转化效率存在着较大的限制,只有百分之二十多,不能对其更有效的利用。而氢气最为清洁能源具有燃烧热值高,无毒无污染等优点,被认为是最具有前景的清洁能源。氢气不仅可以直接燃烧提供能量,而且可以通过一些处理和转换把其它的能源转化为氢,从而进行存储、使用。然而,氢气目前主要是依靠传统化石能源(如石油、煤等)与水蒸气高温反应来制备,通过这种途径制氢不仅会加快石油和煤炭的消耗,而且制备的氢气纯度较低,同时还会产生大量的二氧化碳,造成温室效应等一系列环境问题,不能做到环境友好和可持续发展。而另一种制氢方法——电解水制氢,相对于化石燃料制氢造成的污染就更加绿色环保,更加高效。首先电解水可以产生纯净的氢气和氧气,生产过程没有污染、操作简便、可循环利用;其次在燃料电池内部催化剂中毒是一个很大的问题,而通过电解水产生的是纯净的氢气,可以大大避免催化剂中毒;此外电解水产生的氢气很纯,没有其他副产物的存在,这也意味着燃烧只会生成水,这将大大减少对环境的污染问题。
一个完整的电解水的过程包括产氢(发生在阴极)(Hydrogen Evolution Reaction,HER)和产氧(发生在阳极)(Oxygen Evolution Reaction,OER),上述过程涉及一步或多步电子转移,每个电子转移都需克服一定的活化能:产氢的实际反应电位与理论电位相差较小,能量消耗少;产氧的实际电位与理论电位相差较大,就意味着反应过程需要克服的能垒大,随之而来的问题就是电化学反应速率降低和需要更多的能耗。因此,如果电解水制氢想要实现有效的工业推广,获取高效的析氢/析氧电催化剂将必不可少。
目前,高效的析氢催化剂有Pt及其合金,高效的析氧催化剂有Ir、Ru及其氧化物。这些催化剂在实际应用时能够展现出超高的催化性能,但它们大多在地球上的含量都非常低,成本较高,在进一步商业化使用上受到了限制[1, 2]。因此开发能代替贵金属的稳定、高效、低成本的析氢/析氧电催化剂具有十分重要的意义。
过渡金属氧化物及其衍生物,由于具有丰富的储量、较高的活性、易于调控的位点,在电催化领域受到了较为广泛的研究。有鉴于此,我们选择了地球储量丰富、价格低廉同时外层电子易于调控的Co/Mo过渡金属作为研究对象,希望通过调控Co/Mo基纳米材料的结构,实现高效的电催化(析氢/析氧)活性,并结合原位表征技术和理论计算揭示材料的本征催化机理。
1.2电催化分解水
1.2.1电解水简介
电解水是利用直流电通过电解液分解水而产生氢气和氧气的过程,该过程工艺简单高效且无污染,因此电解水制氢被认为是最有前景并满足可持续发展要求的制氢技术。电催化分解水装置主要由电解池、阳极、阴极、外接电源五个部分组成。其装置简易示意图如图1.1所示。当在外接电压的作用下,电解池中的氢离子这时会向阴极移动,在阴极表面得到电子被还原,生成氢气(即析氢反应过程);同时,电解池中的氢氧根离子不是固定不动的,它则向阳极一定,在阳极表面失去电子被氧化生成氧气(即析氧反应过程)[3]。在实际的应用装置中为了方便收集产物(氢气和氧气),人们会在阴极和阳极间加装一个隔膜。
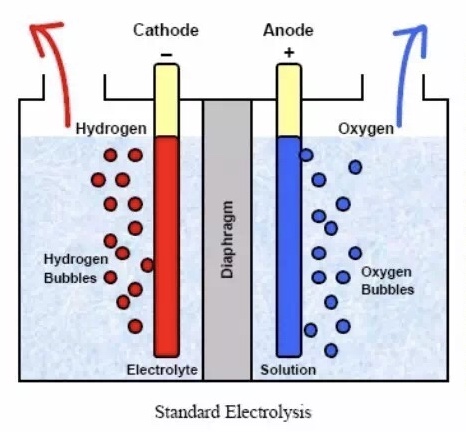
图1.1 电解水装置图
在25℃及一个标准大气压下,通过计算可知电解水所需外加的最低为1.23 V。相对于标准氢电极(Reversible Hydrogen Electrode,RHE),析氢反应的平衡电位为0;析氧反应相对于标准氢电极的平衡电位是1.23 V,结合热力学能量的变化,根据以上结果我们可以通过计算得到电解水所需外加的最小电压为1.23 V[4]。但在实际反应过程中,跟理论上有着很大的差别,这主要是因为:首先电解池本身以及电极材料和电解液界面之间有一定的内阻会消耗能量,从而使所需电势升高,这是无法避免的;其次外接电路的导线也存在电阻,同样会消耗能量产生热量,使所需电势升高,这些因素最终都会导致实际电解水过程中所需的外加电势高于标准电势,即所需外加电压一般高于1.23 V,我们通常将这种由于电解池内阻等原因导致所需电势超过标准电势的部分定义为过电势(overpotential)。但是产生的氢气的量只和反应中电子的迁移量成正比,所以过电势就是电解水反应所要多消耗的能量。因此,我们往往在电解水的过程中需要引入催化剂,催化剂能够降低反应的能垒和所需活化能,从而降低电解水的过电势,进而减少电催化分解水的能量损耗[5-7]。
1.2.2电解水原理
- 析氢反应
析氢反应发生在电解池的阴极,含有多步基元的反应,通常包括吸附、脱附、电子转移等连续步骤,目前其动力学反应的原理一般从三个反应过程去解释[8]:Volmer反应、Heyrovsky反应和Tafel反应。
- 水分子电还原与氢原子吸附过程(Volmer反应)
Volmer反应过程中,电子通常在电解池中电极表面发生转移,此时在电极的表面会出现一些空白活性位点,转移的电子则能够与这些位点上的质子发生作用,进而在电极的表面生成了H原子,且这些H原子能够牢牢地吸附在电极表面:
在酸性溶液中质子由水和氢离子提供:M H3O e- → M - Hads H2O
在碱性溶液中质子由水裂解提供:M H2O e- → M - Hads OH-
- 氢气的电化学脱附过程(Heyrovsky反应)
H3O 和被吸附在电极表面上的H原子反应生成H2:
在酸性条件下反应方程式为:M - Hads H3O e- → M H2 H2O
在碱性条件下反应方程式为:M - Hads H2O e- → M H2 OH-
- 氢气的化学脱附过程(Tafel反应)
吸附在电极表面上的两个H原子化合为H2,2M - Hads → 2M H2
在以上的反应方程式中,M代表反应中的金属原子,Hads 则代表在活性物质表面的氢原子。
- 析氧反应
(1)在酸性条件下:
阴极反应为:4H 4e- → 2H2 E0c = 0V
阳极反应为:2H2O (l) → O2 (g) 4H 4e- E0a = 1.23V
阳极析氧反应的机理为[9]:
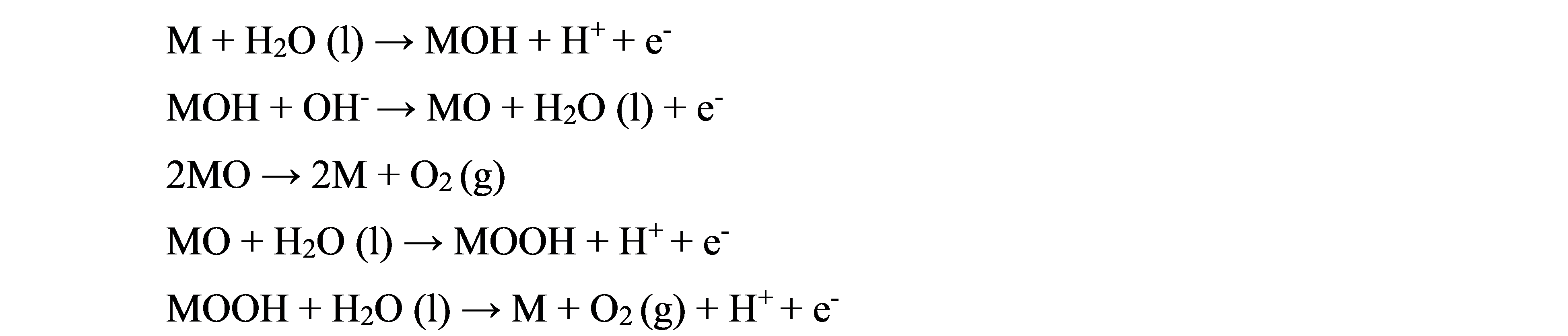
(2)在碱性条件下:
阴极反应为:4H2O 4e- → 2H2 4OH- E0c = -0.83V
阳极反应为:4OH- → 2H2 2H2O(l) 4e- E0a = 0.4V
阳极析氧反应的机理为:
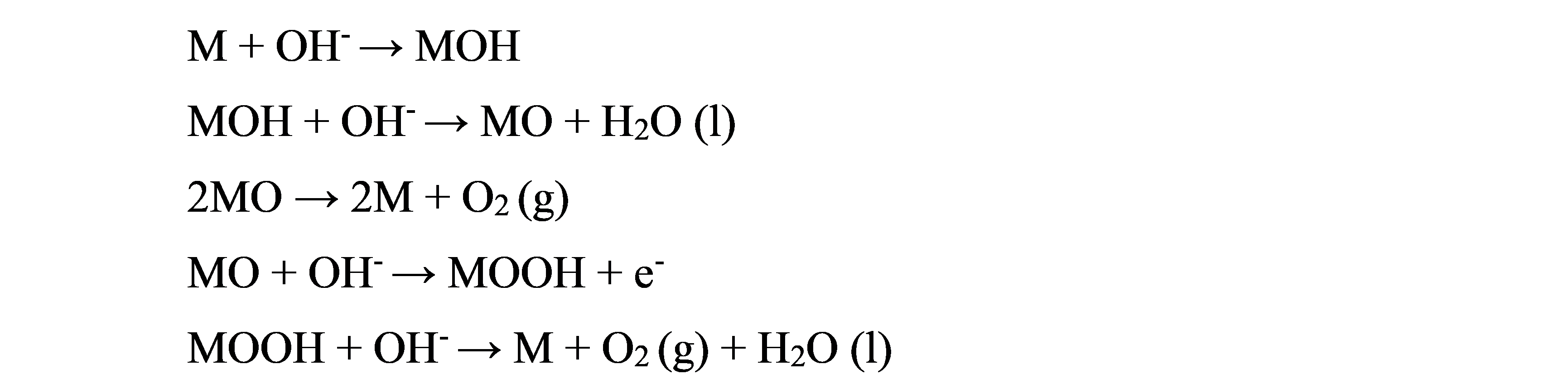
1.3电催化剂
1.3.1电催化剂活性参数
- 过电位
在实际电解水反应过程中,由于热力学和动力学因素的影响,电解水反应发生所需的外加电压比理论值要大,高于理论电压的这部分电压被称作过电位。而过电位对于析氢和析氧反应来说通常分为三种:由于活化过程产生的过电位、浓差作用引起的过电位以及一些存在的电阻在电化学反应过程中产生的过电位。其中浓差产生的过电位产生于一些界面区域,例如在电解池中阳极和阴极与电解液之间就会产生,通常我们可以通过搅拌的方法来减小浓差作用的影响。活化过电位是材料本身的一种特性,不同的材料其活化过电位不尽相同。一般而言,我们通常比较极化曲线中10 mA cm-2的电流密度处的过电势值,以此来评判催化剂材料的电催化活性。通常,催化剂的过电位越低能够表明催化剂的催化活性高,对于大多数的OER催化剂,它们在催化电解水生成氧气所需的过电位一般为0.3-0.4 V,而大多数HER催化剂,在电解水制氢时它们的过电位通常在0.1 V左右。
- 塔菲尔斜率
电催化过程中的塔菲尔曲线是根据极化曲线转化而得到的。具体说来,就是通过极化曲线的数据,用过电位与电流密度的对数作关系图即可得到塔菲尔曲线。电催化过程催化速率的高低一般用塔菲尔斜率来衡量,塔菲尔斜率取自于塔菲尔曲线的直线部分,塔菲尔斜率越低,则说明电催化反应动力学过程越快,说明电流密度随着过电位的增加变化越迅速。因此塔菲尔斜率被认定为是评判电催化活性的基本活性参数。
- 转换频率(TOF)
转换效率能够反映所用催化剂的活性的大小。它是用在单位时间电催化过程中每个反应位点分子的反应数值来表示,其值越大则说明该种催化剂的反应效率高,即活性大。当然催化剂的活性大小不仅仅与TOF值有关,还与反应位点密度、所用活性材料导电性等因素有关,一般用某一个过电位下电催化反应的实际电流密度来衡量活性大小。
- 电化学阻抗(EIS)
电化学阻抗通常能够反映电化学反应过程中电子在材料中的转移速度,速度越快则说明材料的的电化学动力过程快,及催化剂的活性高。其图谱通常由高频和中频区的两个半圆以及低频区的线性直线组成。通过观察图谱中的半圆位置以及线性区域斜率等信息来计算材料的内部阻值信息。
- 电化学活性表面积(ECSA)
电化学活性面积很大程度上影响着催化效率的高低,一般面积越大,说明能够在催化反应过程中提供更多的活性位点,进而提高材料的催化活性。一般研究者们通过用循环伏安法测试催化剂的双电层电容来研究反应活性面积。
- 电化学稳定性
电化学稳定性是影响电催化性能的重要参数,稳定性越好则催化剂能够长时间稳定的对反应进行高效催化,稳定性差则不能使反应维持高效催化。通常用循环伏安法与计时电流法或者计时电位法来表征催化剂的电化学稳定性好坏。
由此可见,良好的电催化剂应当具备以下条件:(1)良好的物理、化学稳定性。耐腐蚀性强,不易脱落,使用寿命长;(2)高的导电率,以此来减少欧姆降;(3)良好的电催化活性;(4)高的比表面积,有尽可能多的催化反应活性位点;(5)价格低廉、储量丰富、制备工艺简单且安全性高。
1.3.2析氢催化剂
- 贵金属催化剂
目前,铂基的金属及其化合物是性能最好的HER电催化剂[10]。然而其价格高昂,储量有限,无法在工业中实现批量生产[11]。实际电解催化过程中Pt的利用率并不高,远远低于100%,所以为了降低催化剂的成本并提高催化反应中对于催化剂的使用效率,往往需要减少Pt的使用量,尽可能提高其原子利用率。目前常见方法如下:1)通过微观调控来改变贵金属的晶体形貌结构;2)将贵金属与其它廉价金属形成合金;3)制备核壳结构;4)选择载体材料表面沉积贵金属。2016年,Sun等[12]人通过巧妙地方法合成出了单原子的Pt金属,使Pt作为电催化时的利用率的到大大提高,展现出了超高的电催化活性,且超过了目前商业上经常用的传统Pt/C催化剂;有文献报道,PtNiCu合金的析氢性能是相同质量的Pt金属的5倍[13]。
- 过渡金属硫化物
过渡金属硫化物具有由于其材料本身介电常数低,且可以通过设计不同的合成方案得到不同形貌结构,电催化活性也较高,受到了科研人员的广泛关注。近年来,Cui等人设计合成了多种过渡金属硫化物(如NiS2、FeS2等)并将其应用于电催化分解水的过程中,发现它们均能展现出优异的电催化性能由此可以发现这类材料具有广阔的应用前景。
- 过渡金属碳化物
过渡金属碳化物具有较好的电催化析氢性能和稳定性,与贵金属Pt相似,且储量丰富,价格低廉,受到研究者们的广泛关注。例如,Chen等[17]人成功通过自模板保护表面活性位点的方法制备了Cu-MoO2微米棒前驱体,进而合成了Mo2C/多孔石墨烯微米棒复合材料,并研究了该材料的电催化析氢性能。高温条件下,铜的存在不仅可以使Mo2C晶粒的生长受到抑制,晶粒的尺寸得以减小,还起到了保护Mo2C表面的金属活性位点的作用。实验表明,该材料仅需电位为145 mV就可以达到10 mA cm-2电流密度,且具有较小的塔菲尔斜率,显示出优异的电催化活性。
- 过渡金属磷化物
作为一类重要的催化剂,不仅导电性较好,而且稳定性较为优良。科学研究表明,FeP介孔纳米片的过电位仅0.1 V,塔菲尔斜率为67 mV dec-1,显示出优异的HER催化活性[18],在过渡金属磷化物中最先被应用于HER反应。近几年,有人报道过渡金属及合金磷化物具有高的催化活性及高的稳定性。Tian等[1]人用水热法在碳布上制备CoP纳米阵列,电化学测试表明在10 mA cm-2的电流密度下过电位为67 mV,塔菲尔斜率为51 mV dec-1。在钛片上生长FeP阵列,磷化反应时,FeP的微观形貌得以保持,且具有良好的稳定性,HER电催化活性可与Pt相媲美。
1.3.3析氧催化剂
- 贵金属催化剂
对于析氧反应来说,要想实现阳极的氧化,所需的电位比氧的平衡电位要高。研究发现,由于热力学的不稳定性,有许多金属催化剂不能进行完整的电催化析氧反应。在OER反应前,电极表面的金属本身会发生氧化反应甚至会溶解在电解液中,或者在OER反应时发生金属的腐蚀,从而导致催化剂的稳定性变差。目前为止,铱、钌及其化合物的OER电催化性能最好[19],但是由于其价格昂贵,储量有限,很难实现大规模使用。为了降低催化剂制备的成本,通常通过掺杂的方法来进一步提高其电催化性能,例如可以制备合金材料,加入Ni、Mo等非贵金属元素。Cheng等[20]人成功在IrO2-RuO2催化剂中引入Mo元素,通过对透射电子显微图像的分析,可以看到Ir0.4Ru0.6MoxOy是由更小的纳米颗粒组成的,平均粒径为2.4 nm。其中铱原子、钌原子以及钼原子生成了Ir(Ru)-O-Mo,热处理过程中,这种物质可以抑制微晶的生长,从而使电催化活性得到了提高。
- 过渡金属氧化物
过渡金属氧化物属于非贵金属催化剂中的一类析氧催化剂,受到了较为广泛的研究。虽然具有尖晶石结构的Co3O4具有良好的OER催化性能,但仍然与实际应用有一定的差距。所以人们一直在研究优化其OER催化性能,利用组分内部电子间的相互作用,掺杂或者混合氧化物所产生的协同效应来改善氧化物的物理及化学性质,以此提高氧化物的析氧催化活性。例如,Zhao等[21]人制备了Fe、Ni掺杂的介孔Co3O4材料,发现掺杂的Fe与Co3O4之间产生了协同效应,增大了催化剂的活性位点,改善了材料的导电性能,有效提升了材料的电催化活性。
- 过渡金属氢氧化物
过渡金属氢氧化物不仅价格低廉,而且电催化性能也较好,此外还具有良好的稳定性,一直是析氧催化剂的研究热点。Peng课题组通过溶液凝胶法制备多孔Ni(OH)2纳米片,使纳米片具有更高的比表面积,更丰富的缺陷和更多的晶界及边缘位置。同时,片状结构内部的微孔可以为离子吸附和运输提供通道,实现快速的界面电荷转移并加速反应过程,在335 mV的过电位下,电流密度就可以达到10 mA cm-2,塔菲尔斜率为65 mV dec-1,具有优异的OER催化性能[22]。
- 层状双金属氢氧化物
作为一种阴离子型层状化合物,LDHs的结与水镁石非常相似。因为不同金属离子之间的协同作用,双金属氢氧化物比单一金属氢氧化物的OER催化性能更好,吸引了众多科学家的极大关注。例如,Feng课题组成功制备了Ru掺杂的NiFe-LDH材料,并将其用于电催化分解水析氧反应的研究。发现催化剂优异的OER活性,在外加电压为1.52 V时的电流密度可达10 mA cm-2,且具有优异的稳定性[23]。
- AB2O4 型尖晶石型化合物
尖晶石化合物的成本低廉、电阻较低、催化活性良好、热力学性能较好,是一种非常重要的功能材料。目前,尖晶石类化合物在众多领域,如电性能研究、磁性能研究、催化研究、能源材料领域等都受到了广泛的应用。这种材料。在这一类氧化物中,NiCo2O4由于具有较高的电化学活性,以及在碱性电解质溶液中耐腐蚀和成本相对低廉等优点,被认为是当前最具前景的碱性水电解阳极材料[24]。
1.4本论文选题意义及主要研究内容
随着人类社会的不断发展,人们对能源的需求量也越来越大,随之而来的环境污染及能源危机问题也日益严重。氢能因其来源丰富,绿色无污染等特点被视为最有前景的新型清洁能源。电解水制氢是一种高效的制氢技术,产氢纯度高,但存在电催化剂活性低以及成本高昂等问题,所以电解水制氢技术的广泛应用受到了严重限制。因此,开发可代替贵金属的低价高效且地球储量丰富的电催化剂迫在眉睫[25, 26]。
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: