过渡金属掺杂 MoS2 电催化二氧化碳的第一性原理研究毕业论文
2021-12-02 13:08:09
论文总字数:23051字
摘 要
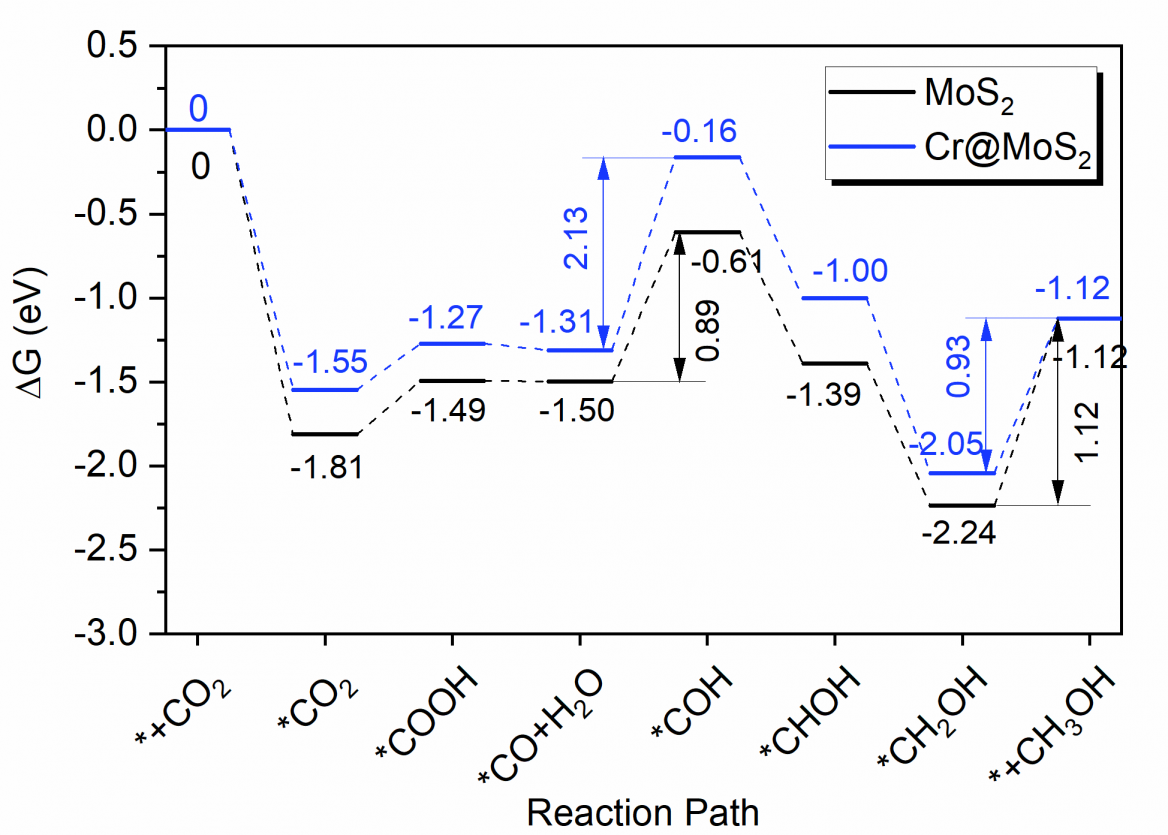
二氧化碳的大量排放已经对环境和可持续发展带来了巨大的威胁。采用清洁能源将二氧化碳还原成具有经济附加值的工业原料是一种潜在的解决方案。本论文采用第一性原理密度泛函理论从理论上探索了过渡金属铬掺杂的单层二硫化钼体系作为催化剂电催化还原二氧化碳的反应机理,并与未掺杂的单层二硫化钼体系进行对比。研究发现,铬掺杂前、后的单层二硫化钼体均可以活化二氧化碳分子。由生成的*COOH中间体可以分成两条反应路径,分别生成甲酸和甲醇两种产物。铬掺杂的单层二硫化钼催化剂的更利于生成甲酸,而未掺杂的单层二硫化钼催化剂的更倾向于生成甲醇。
关键词:二氧化碳还原;过渡金属掺杂二硫化钼;第一性原理;密度泛函理论;反应机理
Abstract
The massive emission of carbon dioxide (CO2) has been a serious threat to environment and the sustainable development. A promising strategy to solve this problem is turning CO2 into valuable industrial products via reduction reaction by using clean energy. In this study, the electrochemical catalysis mechanism of CO2 reduction reaction on the chromium doped molybdenum disulfide (Cr@MoS2) was investigated and compared to the non-doped MoS2, by means of the first-principles density functional theory. The intermediate *COOH leads two reaction paths, producing formic acid and methanol, respectively. The single layer Cr@MoS2 is more conductive to generate formic acid, while the non-doped single-layer MoS2 is more favorable to yield methanol.
Key Words: carbon dioxide reduction; transition metal doped molybdenum disulfide; first-principles; density functional theory; reaction mechanism
目 录
第1章 绪论 1
1.1引言 1
1.2 CO2还原方法 1
1.2.1 CO2的催化加氢还原 1
1.2.2 CO2的光催化还原方法 2
1.2.3 CO2的电催化还原方法 3
1.3 MoS2材料研究简介 4
1.4本论文研究内容及工作 5
第2章 理论计算原理 6
2.1 第一性原理简介 6
2.2 密度泛函理论 6
2.3 材料模拟软件介绍 7
第3章 理论计算方法 8
3.1 模型体系的搭建 8
3.2 计算参数设置 9
第4章 结果和讨论 11
4.1 二氧化碳电催化还原的反应机理 11
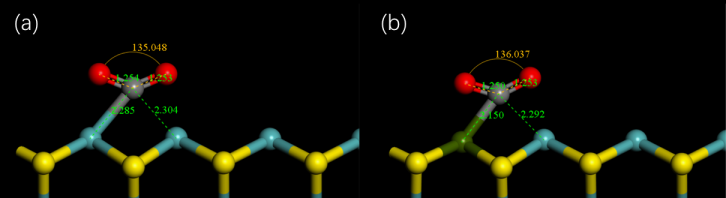
4.2 反应物的结构参数变化 12
4.3 反应物、中间体、产物的Gibbs自由能 13
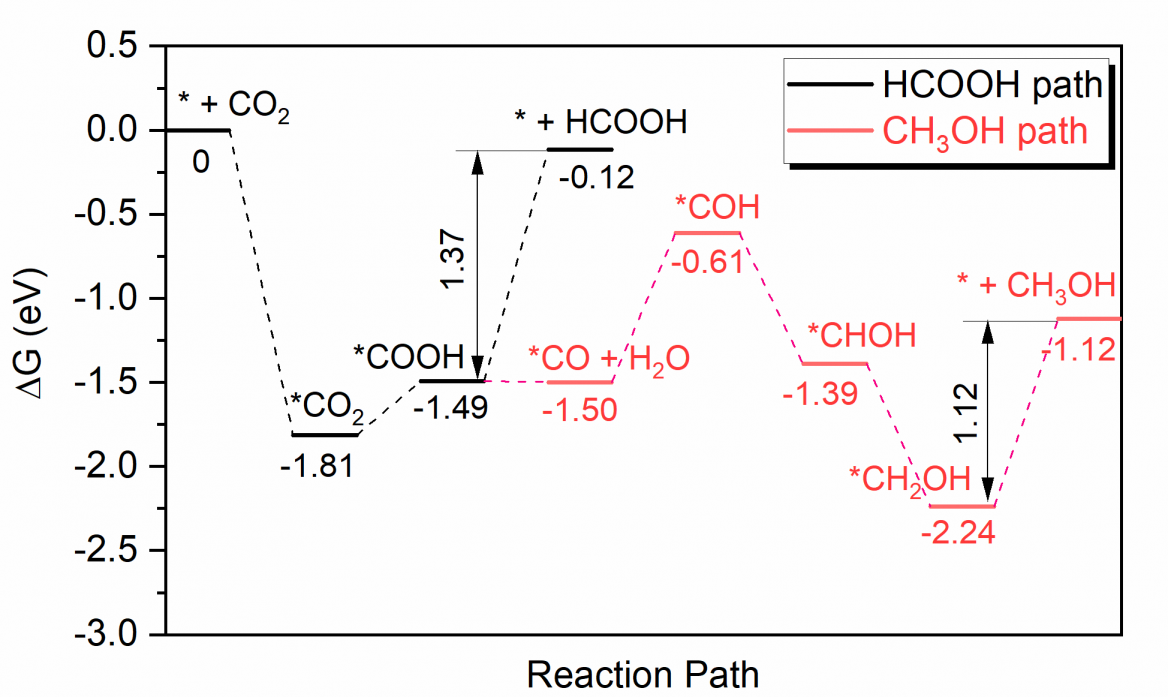
4.3.1 二氧化碳在单层二硫化钼表面上的电催化还原路径 14
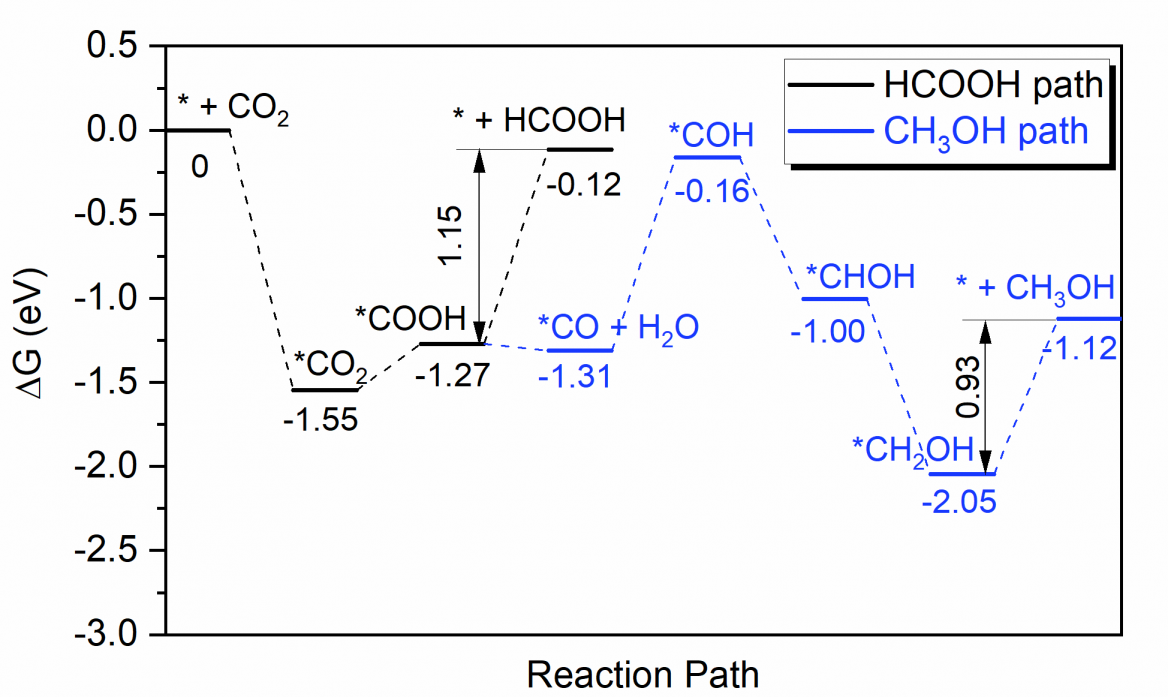
4.3.2 二氧化碳在铬掺杂的单层二硫化钼表面上的电催化还原路径 15
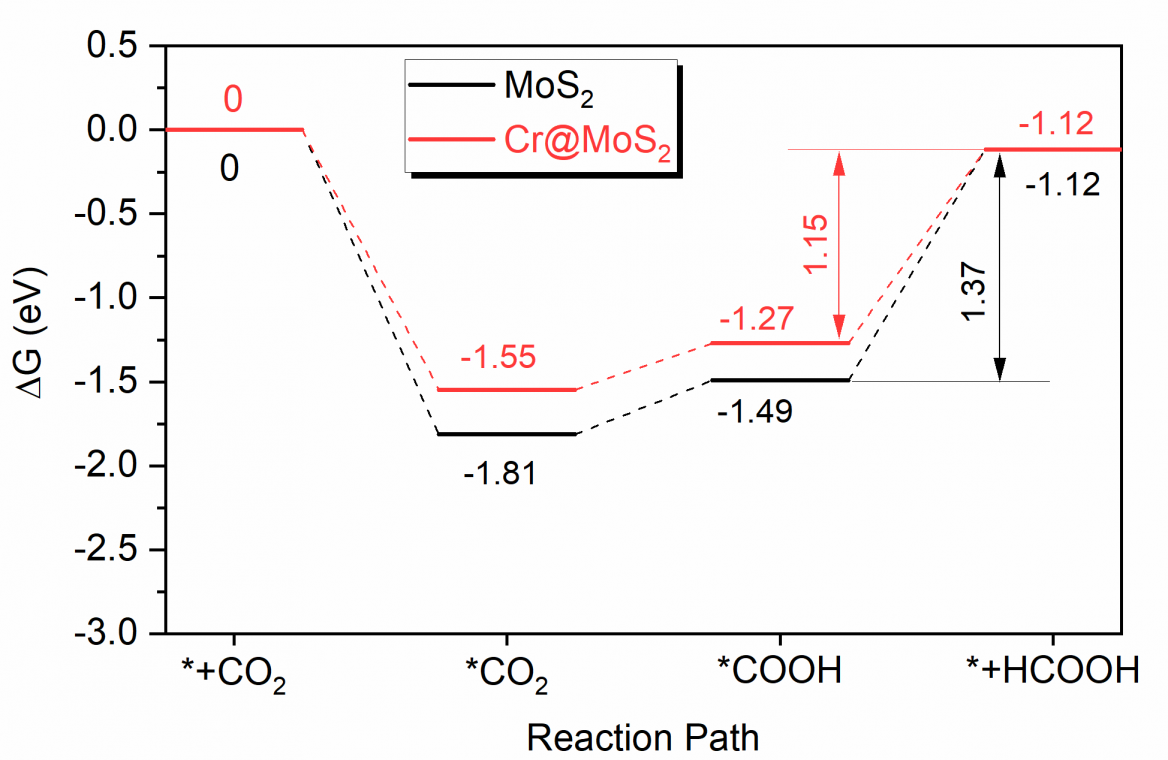
4.3.3 铬掺杂前、后对二氧化碳电催化还原路径的影响 15
第5章 结论与展望 18
参考文献 19
致 谢 21
第1章 绪论
1.1引言
二氧化碳(CO2)是大气中主要的温室气体,也是植物光合作用和许多化学物质的重要原料[1],因此,维持大气中二氧化碳的平衡十分重要。自从进入工业化时代,人类社会对于化石燃料的广泛利用已排放了大量的二氧化碳(CO2),快速大量的排放已经导致二氧化碳在大气中含量的增高,并深远地影响了地球生态。依照目前趋势,人类如果不采取措施,环境将进一步恶化,甚至会威胁到人类文明的发展。
为了减少大气中二氧化碳的含量,降低排放量和增加回收利用量是两条合理的途径。在减少二氧化碳排放方面,国际上制定了《京都议定书》,《巴黎协定》等条约[2],已有许多国家签署以上条约并制定了相关减排计划。中国作为世界上最大的发展中国家积极推动巴黎协定通过,展现出“负责任大国”的担当。但是,限制碳排放的代价是需要牺牲一部分的经济发展,所以单纯的减排并不能算是妥善的方案。事实上,由于二氧化碳可以作为原料生产碳基燃料[3],人类可以通过还原二氧化碳来制造燃料用于能源供应[4]。也就是说,掌握二氧化碳回收转化的成熟技术将比较全面地照顾到环境保护和经济发展两个领域。到目前为止,相关的科学研究和技术探索仍有很长的路要走。而想要取得比较长远的进步,对于一些关键反应的反应机理研究就显得十分重要。本文将通过利用第一性原理计算的方法来探究MoS2上掺杂过渡金属后电催化CO2还原的机理。
1.2 CO2还原方法
目前人类主要依赖化石燃料(大部分是石油和煤炭)进行能源供应,且在可预见的未来数十年中仍需要利用大量化石燃料[5]。由于化石燃料是不可再生能源,所以其大量的利用将加剧能源危机[6]。石油煤炭在燃烧过程中会产生大量二氧化碳气体,二氧化碳的含量过高会加强温室效应,导致气候变暖,破坏生态平衡。所以人类正同时面临能源危机和环境恶化两个难题。利用化学反应还原二氧化碳用来生产碳基燃料和化学物质将会有效地解决上述两个问题。
CO2具有很好的热稳定性[7],因此使CO2进行还原反应有很大挑战。现有关于CO2还原方法主要有三种,分别是催化加氢还原,光催化还原和电化学还原。
1.2.1 CO2的催化加氢还原
在一定环境中利用H2直接将CO2还原为目标产物的方法称为催化加氢还原。H2可以利用电解水获得,二氧化碳在被氢气还原后可得到丰富类型的产物,主要有一氧化碳和甲醇等。还原产物的差异由不同的还原路径决定,但无论是什么还原路径,它们都有生产效率低,反应条件苛刻等缺点。为了解决上述问题,对相关的催化剂研究和开发十分关键。
最为理想的催化剂是同时具有良好的活性与选择性。目前有均相和非均相两大类催化剂,均相催化剂对一些物质的合成有较好效果,但均相催化剂大多是储量较小的金属且价格成本高而不适用于工业化利用[8]。非均相催化剂大多是过渡金属元素,储量充沛,更适合在工业化中使用。不过,非均相催化剂选择性和活性都有待提高。目前,比较经典的非均相催化剂是Cu,Cu作为唯一一种以高法拉第效率产生碳氢化合物的过渡金属,被认为是将二氧化碳还原为甲醇进行工业化最合适的金属催化剂。但是单一的Cu也具有过电位较高活性位点不足等缺陷。
Liao等人[5]制备了纳米尺寸的Cu-ZnO,并将其制造成不同形貌用于催化加氢还原二氧化碳,实验结果表明,催化剂的活性受到形貌影响。Behrens等人[5]对不同催化剂催化二氧化碳加氢还原进行了研究,通过DFT计算得出活性位点主要集中在Zn原子修饰的Cu台阶,这是由于缺陷的产生调控了催化剂的电子性质。催化加氢还原已有一定工业基础,但想进一步推广工业生产,对优质的催化剂的开发至关重要。
1.2.2 CO2的光催化还原方法
太阳能具有来源清洁、使用方便、储量丰沛等优点,利用太阳光作为能源供应对CO2催化还原是一个发展前景良好的研究方向。1978年,Halmann第一次报道了其利用GaP半导体光电极系统进行的二氧化碳还原,成功将CO2转化为HCHO、CH3OH、HCOOH。开创了光催化还原CO2的研究领域。CO2光催化的催化剂主要是半导体催化剂,原理是半导体催化剂在太阳光照射下产生光生电子-空穴对,再由激发的光生电子还原CO2,光生空穴氧化H2O,再通过一些中间步骤就可将CO2还原为甲醇甲烷等物质。
由于CO2分子的最低空轨道和最高占据轨道带隙差距较大,所以还原CO2需要较高的过电位[8]。为了减小过电位,可以将CO2吸附在光催化剂表面使得CO2的直线结构弯曲,这样能够降低反应能垒[8]。对于光催化反应来说,催化剂光响应效率太低会导致太阳能的利用率不足,人们需要设计较宽光响应范围的催化剂调高能量利用率,表面缺陷工程在调节光吸收区域方面有比较理想的效果[9]。光生电子空穴对在生成后会自发复合,这会大大降低CO2还原的效率。设计合理的助催化剂能够解决这一问题,目前较常使用的是贵金属助催化剂。Hu等人[10]研究发现,在金属体系中适当引入二硫化钼材料可以提高电子空穴分离效率。助催化剂在反应中可以阻碍电子空穴对的复合,延长它们的寿命,使更多CO2分子被还原从而提高反应效率。可见,在光催化研究领域,研究重点是设计制造相应催化剂和助催化剂。
1.2.3 CO2的电催化还原方法
电化学催化还原CO2是一种较为理想的CO2还原方案,可将电能转化为化学能。主要过程就是利用电能在电极上建立电位差,使CO2分子在阴极上被还原为小分子化合物,CO2分子来自于大气,电能可以通过可再生能源转化得到,既可以有效利用CO2,降低空气中CO2的浓度;又可以把间歇性能源转变为稳定的化学能进行储备。跟催化加氢还原和光催化还原比较起来,电催化具有如下几个优点:(1)产物选择性高。可通过电势、反应温度等条件的改变来调控产物种类。(2)原料来源丰富,取用方便。因为CO2电催化还原是在电解液中进行,反应的消耗物实际上只有CO2和H2O。(3)反应条件温和。电化学还原CO2可在室温和常压下进行。(4)易于工业化推广。电化学反应的装置比较紧凑,可以按比例放大后推广到工业应用中。因此众多科研工作者投入到对电催化还原的研究中。自这项技术提出以来,人们在理论和实践上都取得了重大进步。尽管如此,目前的电催化仍然具有催化过电位过高,产物选择性较低等缺陷。为了弥补这些缺陷,开发高选择性低过电位的催化剂至关重要。
在电化学还原CO2中,Cu是最常用的金属催化剂,具有高法拉第效率和中等的氢过电位,与CO的相互作用比较弱。Cu在不同表面催化能得到不同的产物,在Cu(111)表面主要形成CH4,在Cu(100)表面主要形成C2H4。欧利辉等人[2]利用DFT计算探究了CO2在Cu表面还原成碳氢化合物的机理。发现在电化学环境中,当电势高于−0.5V时,Cu(111)表面主要形成HCOO−和CO吸附物。电势降低过程中,CO2更加趋向质子化形成CO。电势为−0.67V时,CO是主要产物。电势继续降低,形成碳氢化合物的趋势变强。在气相还原中,CO质子化形成的中间体CHO倾向于进一步氢化形成CH2O中间体;在电化学环境下,CHO中间体更容易解离形成CH[2]。
请支付后下载全文,论文总字数:23051字
相关图片展示:
您可能感兴趣的文章
- 碳点修饰SiO2纳米球的制备与表征文献综述
- 二维VOPO4纳米片在水系锌离子电池中的研究文献综述
- 塑料注射成型的实验研究: 型腔压力和模具温度对产品质量的影响外文翻译资料
- 一种用于同时电化学检测铅(II)、镉(II)和锌(II)的具有分层MXene-铋纳米复合材料的微铣式微电网传感器外文翻译资料
- 日光驱动的可充电抗菌和抗病毒纳米纤维膜在生物保护中应用外文翻译资料
- 一种无金属的聚合物光催化剂,用于在可 见光下从水中制氢外文翻译资料
- 二维共价自组装:将共价有机骨架纳米球连接到晶体和多孔薄膜中外文翻译资料
- 模拟二维材料的粉末X射线衍射图外文翻译资料
- 基于碳化硅反应活性的烧结添加剂外文翻译资料
- 阳极氧化TiO2纳米管阵列的形成、形态控制和应用外文翻译资料




