生物膜的酶解研究毕业论文
2020-04-08 13:23:54
摘 要
本文主要对金黄色葡萄球菌和铜绿假单胞菌产生的生物膜进行了酶解的相关研究。并对化学去除生物膜和生物膜酶解进行了对比,所得结果有利于找到生物膜控制的新思路。
论文主要研究了培养时间、菌种和蛋白酶K作用3个因素对生物膜形成的影响;对比了不同酶和不同酶浓度以及金属离子对生物膜酶解的影响;比较了化学去除生物膜与生物膜酶解的优缺点。
研究结果表明酶的种类、酶的浓度以及金属离子都对生物膜酶解有影响,并且浓度很低的酶对生物膜酶解的效果与化学试剂去除生物膜不相上下。证明生物膜酶解存在着异质性;同时相较于化学试剂去除生物膜,生物膜酶解有很高的效率优势。
生物膜的难以去除不仅损坏了各种设备和仪器,更是医疗感染和食品污染的主要原因。现在生物膜的去除仍然主要以物理清洗和化学试剂消毒为主,目前没有有效的抑制生物膜的手段。本文将生物酶与化学试剂相比较,在探究基础的生物膜形成和生物膜酶解的前提下,讨论了化学试剂去除生物膜与生物膜酶解的优缺点。一定程度上为生物膜的控制提供了新思路。
关键词 生物膜 脱氧核糖核苷酸 金黄色葡萄球菌 蛋白酶K 铜绿假单胞菌
Abstract
This article mainly focused on the enzymatic hydrolysis of Staphylococcus aureus and Pseudomonas aeruginosa biofilms. The comparison between chemical removal of biofilm and enzymatic hydrolysis of biofilm was carried out, and the results obtained were helpful to find a new idea of biofilm control.
The paper mainly studied the effects of culture time, bacterial species and proteinase K on biofilm formation; compared the effect of different enzymes and different enzyme concentrations and metal ions on enzymatic hydrolysis of biofilms; compared chemical removal of biofilms and organisms The advantages and disadvantages of membrane enzymatic hydrolysis.
The results showed that the type of enzymes, enzyme concentration and metal ions all have an impact on the enzymatic hydrolysis of biofilms, and the enzymatic hydrolysis of biofilms by enzymes with very low concentrations is comparable to the removal of biofilms by chemical reagents. It is proved that there is heterogeneity in the enzymolysis of biofilms; at the same time, biofilm enzymatic hydrolysis has high efficiency advantages compared to the removal of biofilms by chemical reagents.
The difficult removal of biofilm not only damages various equipment and instruments, but is also the main cause of medical infections and food contamination. At present, the removal of biofilms is still mainly based on physical cleaning and chemical reagents disinfection. Currently, there is no effective method for inhibiting biofilms. This paper compares the biological enzyme and chemical reagents, and discusses the advantages and disadvantages of chemical reagents for biofilm biofilm biofilm digestion under the premise of exploring basic biofilm formation and biofilm enzymolysis. To a certain extent, it provides new ideas for the control of biofilms.
Keywords biofilm; Bp-DNaseΙ; ProteinaseK; Staphyloccocus aureus; P.Aeruginosa
目录
第1章 绪论 1
1.1生物膜 1
1.1.1生物膜的概述 1
1.1.2细菌生物被膜的结构 1
1.1.3细菌生物被膜的形成及其机制 2
1.2细菌生物膜的控制 3
1.2.1物理清洁结合化学消毒 3
1.2.2 新材料方法 4
1.2.3化学生物学方法 4
1.2.4存在的问题 5
1.3细菌生物膜的检测 5
1.3.1生物膜常用定性检测方法 5
1.3.2生物膜常用定量检测方法 6
1.4蛋白酶K(ProteinaseK) 6
1.4.1蛋白酶K的结构 7
1.4.2蛋白酶K的性质和功能 7
1.4.3蛋白酶K的应用 8
1.5牛胰腺脱氧核糖核酸酶Ι 8
1.5.1Bp-DNaseΙ的结构和性质 8
1.5.2Bp-DNaseΙ的应用 8
1.6研究的目的,意义和内容 8
1.6.1本论文研究的目的和意义 9
1.6.2本论文研究的内容 9
第2章实验材料和方法 11
2.1实验材料 11
2.1.1实验试剂和仪器 11
2.1.2实验菌种 12
2.1.3部分试剂的配制 12
2.2实验菌种培养方法 13
2.2.1菌种复苏与保藏 13
2.2.2待测菌液培养 13
2.3生物膜检测方法 14
2.3.1结晶紫染色 14
2.3.2定性检测 14
2.3.3定量检测 14
第3章 生物膜形成的影响因素 17
3.1引言 17
3.2培养时间对于形成生物膜的影响 17
3.3菌种对于形成生物膜的影响 18
3.4蛋白酶K浓度对生物膜形成的影响 19
3.5本章小结 20
第4章 生物膜酶解的影响因素 21
4.1引言 21
4.2酶的种类对生物膜酶解的影响 21
4.3酶的浓度对生物膜酶解的影响 22
4.4金属离子对生物膜酶解的影响 23
4.5本章小结 24
第5章 化学去除生物膜与生物膜酶解的比较 26
5.1引言 26
5.2螯合剂EDTA去除生物膜与酶解比较 26
5.3表面活性剂SDS去除生物膜与酶解比较 27
5.4本章小结 27
第6章 结论与展望 29
5.1结论 29
5.2展望 30
参考文献 31
致谢 34
第1章 绪论
1.1生物膜
1.1.1生物膜的概述
生物膜(biofilm)是微生物为适应生存的环境,提高自身生存力而形成的特殊膜层结构。细菌生物被膜(Bacterial biofilm,BBF)由细菌细胞以及细菌分泌的包裹着细菌的胞外基质(Extracellular polymeric substances,EPS)组成的结构性细菌群落[1]。
文献表明[2-4],生物膜广泛存在于各种条件下,尤其是潮湿的表面;例如医疗设备、植入生物体内部的器械、食品加工设备、生产管道、通风装置、自来水管道等。加工产业中,生物膜内细菌的代谢活动不仅影响加工品的治疗,更严重的是代谢产生的物质会腐蚀管道,损伤加工器械。医疗产业中,生物膜的存在会增强细菌的耐药性,加重感染;同时细菌代谢的废物会在生物膜的作用下进一步积累,引发机体长期的炎症反应。食品工业中,细菌生物膜不仅破坏工业设备,同时生物膜粘附在加工设备表面是难以忽视的食源性疾病来源。
细菌生物被膜的概念首次由Costerton[5]在20世纪70年代时提出。形成生物膜几乎是所有细菌的能力,人们渐渐意识到生物膜形式存在的细菌数量庞大。国内外的研究主要是在了解生物膜的结构、生理生化特点、调控机理和形成机制的基础上,建立高效、灵敏、快速的检测方法,进而利用物理、化学、生物等多方面学科手段进行探究,从而找到合适的控制方法。
1.1.2细菌生物被膜的结构
直到20 世纪 80 至 90 年代 ,激光共聚焦显微镜(laser scanning confocal microscopy, LSCM)等检测仪器的出现,生物膜的精密结构才逐渐被发现。如图为生物膜结构的示意图。
Lawrence[6] 等发现细菌生物膜中细菌含量不足 1/3,大部分是细菌分泌的胞外黏性物质。根据Habash[7]等提出的成熟生物膜结构模型,如图1.1,生物膜由内到外依次可划分:生物被膜层、连接层、条件层和基质层。生物膜浅层中细菌包裹在自身分泌的胞外基质中,形成微菌落。微菌落的间隙分布着物质运输的通道,主要包括氧气、营养物质的输入和各种代谢废物的输出。但在生物膜深层的细菌不易得到氧气和营养物质,代谢率很低,同时也很难将代谢废物排出。因此深层的细菌大部分处于休眠状态,体积较小,很少有频繁的细胞分裂活动,对于杀菌剂敏感性很低。
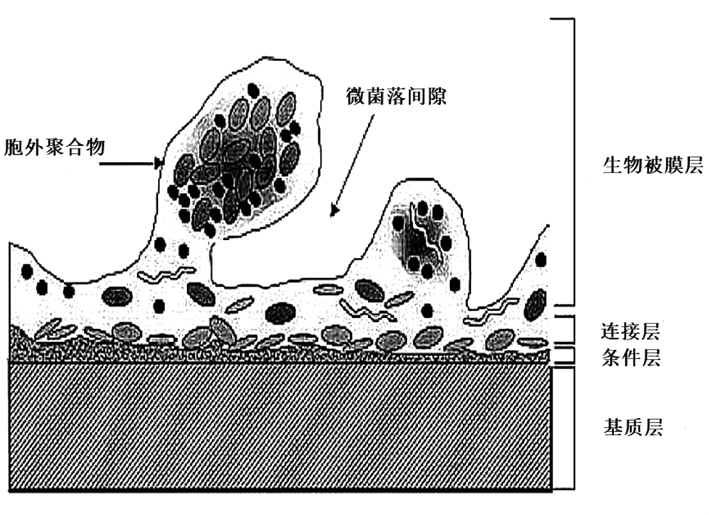
图1.1 成熟细菌生物被膜的结构模型[8]
生物膜的结构组成具有异质性,即生物膜形成过程中受到多种因素的调控,菌种,营养物质,环境条件,培养时间等都会影响到最终生物膜的形态。Lawrence[1][6] 等发现不同菌种的生物被膜的三维结构不同, 并且附着于不同的表面上。
1.1.3细菌生物被膜的形成及其机制
生物膜的形成是动态的[9],不同文献对生物膜的形成机制描述有出入,划分的阶段也有一定差别,没有统一标准。本论文结合其他文献,根据生物膜的形成规模将生物膜的形成总体分为粘附定值、形成微菌落、生物膜的成熟和生物膜
扩散4个阶段。如图1.2所示,为模拟的生物膜形成的过程


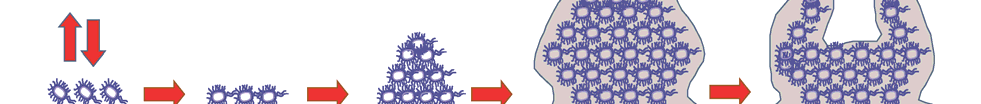

图1.2 生物膜形成过程示意图[10]
细菌的粘附定值是可逆的,该阶段细菌主要受到非生化作用力,如路易斯酸碱作用力,范德华力、疏水性和静电力等。主要是粘附素感知并吸附,因此具有一定的选择性和特异性。同时鞭毛和菌毛在初始粘附中也是主要动力之一。但是初始粘附阶段缺乏成熟的生物膜的保护,使用简单的物理去除并加热消毒即可有效除去。
形成微菌落阶段是不可逆的,细菌在生长繁殖的同时会分泌大量的生物膜胞外基质(EPS),慢慢形成单一或多种的微菌落。形成微菌落的阶段,EPS含有的蛋白质、多糖、核酸和磷脂等受到多种信号调控产生并互相黏连,进而粘附于物体表面,粘附力从可逆转变为不可逆。细菌形成微菌落的阶段,生物膜的形成受到环境信号、胞内信号分子、细菌的群体感应系统(Quorum sensing system,QS)等信号因素的调控。例如 Goodman[11-12]等研究发现铜绿假单胞菌胞外聚合物分泌的调节依赖于感应激酶RetS和GacS对环境信号的感测。Conlon[13]等研究发现 Sar A 基因表达的 Sar A蛋白调控icaADBC 基因的表达,控制着细菌间多糖粘附素的表达,从而影响表皮葡萄球菌生物膜的形成。与此相对比的是Toledo-Arana[14]等研究发现 icaADBC基因的缺失对金黄色酿脓葡萄球菌生物被膜的形成没有影响,说明菌种不同,其调控途径不完全相同。
生物被膜的成熟时细菌包裹于 EPS 中,生物膜的模型结构如图1.1;微菌落的间隙中分布着运输网,整个生物膜结构稳定,普通物体方法很难去除。
生物膜成熟后,细菌密度达到阈值并会出发信号导致生物膜解离[38]细菌从生物膜中被释放出来,重复形成新的生物被膜。通常此阶段受到环境条件改变的影响。例如Sauer[15]等发现营养物质的增加会促进生物膜的扩散。
1.2细菌生物膜的控制
根据生物膜的主要成分,对生物被膜的控制主要包括去除已形成的生物膜;杀死已有的微生物;抑制新生物膜的生成3个方面。但很多措施同时可以达到3种要求中的多种。
细菌生物膜具有异质性,动态性和结构复杂性等特点。本文从实际操作技术,结合文献对生物膜的控制主要有以下方法:
1.2.1物理清洁结合化学消毒
定期清洁物体表面并消毒是抑制生物膜形成最主要的方法。定期清洁实体表面,可以在早期减少细菌的量和生物膜的可逆粘附,从而抑制不可逆粘附的产生,减少生物膜的定值。但是EPS本身的三维结构复杂,杀菌剂很难进入生物膜内部,实际灭菌效率低。打碎或溶解 EPS在一定程度上可以大大提高清洁效率。
目前有研究使用的控制生物膜的物理方法主要利用超声波,超高磁场和高电压电场等技术。相比较之下,超声波处理对于设备的要求更低,并且操作简单,危险性较低,不损伤食品,具有较为广阔的前景。
Pitt[19]等发现低频低密度超声波能促进细菌生长,高密度超声波能促使细菌生物被膜从实体表面剥离。Joyce[20]等的研究提出超声波通过一系列物理机械和化学作用,破坏了细菌的形态,打散了细菌的菌群,使细菌失活。Pitt[19]等研究发现,一定频率的超声波会降低细菌鞭毛的运动。他们认为低频高密度超声波破坏了细菌的细胞膜,致使细菌死亡;同时, EPS的结构稳定性也受到破坏,从而控制了细菌生物膜。但是低密度超声只能破坏一部分生物膜的结构,为细胞膜深层提供了氧气和营养物质,并且有利于深层产生的代谢废物的排出。
多项研究表明超声波对于细菌生物膜的控制有两重性,需要根据条件选择。同时,将超声波与部分化学生物学去除方法结合起来,有利于去除效率的提高。
物理方法直接清除可以除去高达90%以上的细菌生物膜,但是需要进一步杀死残留菌体才能有效去除生物膜。因此,需要进行消毒程序[16]。
1.2.2 新材料方法
医疗食品等行业使用的材料经常需要从根源上抑制生物膜的形成,例如医疗植入型材料,食品管道等。材料科学研究的抑制生物膜形成的材料主要从降低物理粘附和利用化学杀菌来进行。例如可以使多孔固体基质材料形成极光滑的表面,降低细菌的吸附指数;利用超疏水材料,同样可以减少细菌的吸附,降低生物膜的形成。
新材料化学杀菌主要是在材料表面涂层抗菌物质。例如Gottenbos[17] 等研究发现的植入的硅酮橡胶共价耦合季铵涂料;Liu[18]等研究发现的亲水性化合物聚乙二醇。但是,表面涂层存在较大的抑菌剂的释放和细菌耐药性等问题。
1.2.3化学生物学方法
生物膜胞外基质(EPS)的形成受到菌种,细菌量,环境温度等多方面因素的影响,具有较大的异质性。同时,EPS结构较为致密,单一洗涤剂很难清除全部生物膜。因此,在应用中经常使用含有复合酶的洗涤剂,复合酶的存在有助于细菌生物膜的降解。Parkar[21]等研究发现将蛋白水解酶与表面活性剂结合后使用可以提高耐热芽孢杆菌的清洁效率。化学生物法并不局限于单一抗菌物质,而倾向于多种天然药物、化学试剂、酶等物质进行混合处理,从而增加崩解生物膜的效率。
1.2.4存在的问题
目前对于生物膜的去除方法仍然很单一,物理方法无法完全去除。物理与化学生物方法结合去除时选择的抗菌剂仍然主要采用抗生素或是化学制剂。但是对于医疗食品等行业,抗菌剂的选用需要高效,无毒,易清除,无残留,同时不影响材料或者食品的原本功能和感官品质。迄今为止,受到有机物、pH值、温度、抗菌剂浓度和处理时间等因素的影响,尚未发现绝对安全有效的抗菌剂;同时,对于传统抗菌剂,细菌的的耐药性逐渐增强。因此, 研究寻找更高效安全的生物膜去除方法和去除剂势在必行。
1.3细菌生物膜的检测
随着各学科领域研究交叉的不断发展,生物膜的检测方法越来越完善。细菌生物被膜的检测方法分为定量检测和定性分析,各研究文献目前的检测手段可根据所检测的物质和基本原理大致分为三类:①检测总细胞数的定量试验(包含活细胞和死细胞);②检测活细胞量的活菌计数试验;③检测生物膜胞外基质成分的定量试验。通过查阅文献[22-25]对目前常用的检测方法进行了比较,并分析了各种方法的优缺点。
1.3.1生物膜常用定性检测方法
生物膜定性分析大多数利用各种染色剂进行染色或者利用光学和光谱学方法,最常用的方法如表1.1。
表1.1 生物膜常用定性检测方法比较
检测方法 | 基本原理 | 优缺点 |
快速银染法 | 将细菌生物膜含有的多糖蛋白复合物染为灰黑色或灰褐色 | 初步判断生物被膜中的多糖蛋白复合物 |
玻璃试管法 | 将气-液界面形成的环状物染色后,比较染色深浅来判定生物膜的形成能力 | 存在一定的主观误差 |
电子显微镜法 | 利用AFM、STEM和LSCM等观察细菌生物膜 | 实验条件要求较高,实验设备较贵重;主要用于对生物膜的立体结构定性分析 |
PCR 法 | 特异性检测体外难以培养的致病菌 | 费时费力 |
1.3.2生物膜常用定量检测方法
生物膜定量检测的方法大部分是不同染色剂染色后进行定量,常用定量检测方法如表1.2。




