石墨烯衍生物在核酸分析中的应用研究毕业论文
2020-02-27 10:48:56
摘 要
聚合酶链式反应(PCR)已经成为现代生命科学中一项DNA体外扩增的重要技术方法。由于它可以在几小时内利用少量的DNA模板大量扩增目的DNA片段,因此被运用在生物医学的很多方面,但是实际运用中经常会受到某些限制,如扩增效率不高、产生许多非特异性产物等,研究人员一直致力于研究优化PCR技术。而随着纳米技术进入人们的视野,许多研究人员开始尝试在生物医学领域利用纳米技术,解决生物医学方面的难题。石墨烯具有高比表面积和良好的生物相容性,在生物医学领域具有广泛的应用前景。本文通过改进的Hummers方法制得氧化石墨烯,并通过与氨在溶剂热条件下反应制备石墨烯量子点。研究两种材料在核酸PCR反应中的应用。研究结果表明:氧化石墨烯和石墨烯量子点都能有效增强PCR反应扩增效率和特异性,但其增强效应与浓度密切相关,高浓度时甚至会抑制目的基因的扩增。
关键词:石墨烯;石墨烯量子点;聚合酶链式反应;扩增效率;特异性
Abstract
At present, polymerase chain reaction (PCR), an in vitro DNA amplification technique, has become an important method in modern life science. It is used in many aspects of biomedicine because of its ability to amplify a wide range of DNA fragments of interest in small quantity within a few hours. However, there are often some limitations, such as inefficient amplification, numerous non-specific products, etc. Therefore, many researchers have been committed to optimize PCR reagents. Many researchers have tried to explore the solution using nanomaterials and nanotechnology. Graphene displays high specific surface area and good biocompatibility has been widely used in biomedical fields. In this work, graphene oxide was prepared by a modified Hummers method, then, graphene quantum dots were prepared through solvothermal reaction in the presence of ammonia. The influence of two materials on the PCR reaction was studied. The results show that both graphene oxide and graphene quantum dots significantly enhance the amplification efficiency and specificity of PCR reaction in concentration-dependent manner. However, the amplification of the target gene was suppressed in the case of the high concentration of both materials.
Key Words: Graphene;Graphene quantum dots, Polymerase chain reaction;Amplification efficiency;Specificity
目录
第1章 绪论 1
1.1聚合酶链式反应概述 1
1.1.1PCR技术的基本原理及基本过程 1
1.1.2 PCR技术存在的问题 3
1.1.3 PCR技术优化方法简介 4
1.2氧化石墨烯概述 7
1.2.2氧化石墨烯的结构与性质 8
1.2.3氧化石墨烯的应用 8
1.3石墨烯量子点概述 9
1.3.1石墨烯量子点的制备 9
1.3.2石墨烯量子点的结构与性质 10
1.3.3石墨烯量子点的应用 10
1.4本论文的研究目的与内容 10
1.4.1研究目的 11
1.4.2研究内容 11
第2章 石墨烯衍生物的制备和表征 12
2.1 引言 12
2.2实验部分 12
2.2.1实验试剂 12
2.2.2实验仪器 13
2.2.3实验方法 13
2.2.4样品表征 14
2.3结果与讨论 14
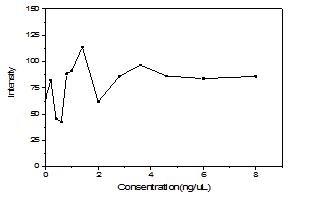
2.3.1GO和GQDs的结构表征 14
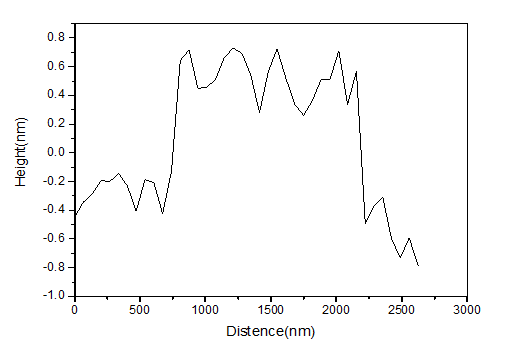
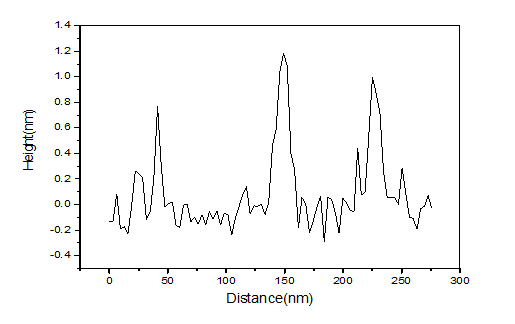
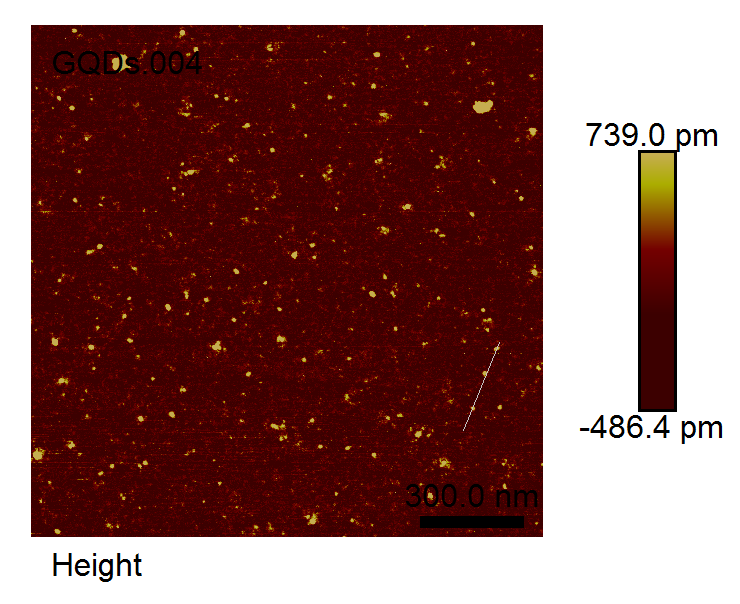
2.3.2 GO和GQDs的形貌表征 15
2.4本章小结 17
第3章 石墨烯衍生物对聚合酶链式反应的影响 18
3.1引言 18
3.2实验部分 18
3.2.1实验试剂 18
3.2.2实验仪器 19
3.2.3实验方法 20
3.3结果与讨论 22
3.3.1氧化石墨烯对PCR扩增的影响 22
3.3.2石墨烯量子点对PCR扩增的影响 23
3.4本章小结 25
第4章 全文总结及展望 26
4.1主要结论 26
4.2展望 26
参考文献 28
致 谢 30
第1章 绪论
1.1聚合酶链式反应概述
常规聚合酶链反应(polymerase chain reaction,PCR)是上世纪80年代中期发展起来的体外核酸扩增技术。它是在体外进行的DNA快速大量复制的过程,具有特异、敏感、简便、产率高、重复性好、易自动化等优点。如今,对DNA的研究已经有了100多年的历史,人们了解到DNA变性与复性的性质,以及DNA半保留复制的过程和原理。1971年,Korana最早提出关于核酸体外扩增的设想:“经过DNA变性、与适当的引物杂交,再用DNA聚合酶延伸引物获得特定DNA片段的复制;不断重复该过程便可获得大量的tRNA基因拷贝。”1983年美国Karry B.Mullis博士在研究过程中首先建立了体外DNA扩增法,但用于这种扩增的大肠杆菌聚合酶有很多缺点,比如不耐高温,在90℃左右就完全变性失活,因此每个热循环低温时都要重新加DNA聚合酶;并且特异性较差,容易发生碱基错配等。这些缺点给PCR操作增添了许多麻烦[1]。1988年初,Keohanog改进了DNA体外扩增技术并用T4 DNA聚合酶进行PCR扩增,且得到了较好的结果,扩增的目的基因DNA片段较为一致,但T4 DNA聚合酶与大肠杆菌DNA聚合酶Ⅰ的Klenow片段一样不耐热。而在1988年,Saiki等发现了耐热的Taq DNA多聚酶(Taq DNA polymerase)[2],很大程度上提高了PCR扩增的特异性,增加了有效扩增长度,使得PCR技术应用能够被推广,从而促进了全自动热循环仪,即PCR仪的发明,是生物医学领域上很大的进步。
1.1.1PCR技术的基本原理及基本过程
PCR技术的反应原理与体内DNA复制相似,但PCR反应更为简单快捷,每次PCR反应合成的产物都能和其模板一起作为下一次DNA合成的模板,使目的DNA片段呈指数形式扩增。PCR体系的DNA合成过程中,DNA变性、退火以及新DNA链的延伸都依靠温度的升降来控制,即通过反复的高温-低温-中温的热循环,使DNA扩增。这样的扩增更加快速和特异。PCR扩增的特异性是由模板DNA和引物两端区域互补的碱基决定的,即PCR扩增中DNA合成过程都以两个引物为起点,当合成产生了以两个引物为端点的DNA片段,则这个DNA片段在之后的热循环理论上也将以2的指数次方进行扩增,因此积累下的DNA片段绝大多数是以两个引物为端点的产物,具有特异性。
PCR的反应体系相对简单,主要包括待扩增的模板DNA、一对可特异性结合待扩增DNA序列的引物、耐热DNA聚合酶、四种三磷酸脱氧核糖核苷酸(dNTP)底物、二价金属阳离子Mg2 、以及PCR缓冲溶液等。一个标准的PCR反应体系的配方如下表1.1所示(100ul反应总体积):
表1.1 PCR标准体系
反应组分 | 100 μl体系 |
10×扩增缓冲液 | 10 μl |
4种dNTP混合物 | 终浓度各200 μmol |
引物 | 各25 μl |
Taq DNA聚合酶 | 2.5 U |
Mg2 | 终浓度1.5 mmol/L |
模板DNA | 0.1~2 μg |
加双或三蒸水至 | 100 ul |
PCR标准反应中通常采用三温度点法,双链DNA在高温(90℃)时变性,再迅速冷却至低温(引物的半解链温度,一般在40~65℃),使引物退火并结合到目的DNA片段上,然后快速升温至中温(70℃),在耐热 DNA聚合酶的作用下,使目的DNA片段延伸。具体反应步骤如下:
(1)高温变性:PCR反应体系中的模板DNA升温至90℃约30s后,模板DNA双链在高温环境下发生双螺旋结构的氢键断裂而变性,形成单链,得到合成DNA的活性模板,为下一步退火做准备;
(2)低温退火(复性):当温度降低至特定温度,即引物的半解链温度(40~65℃)时,单链模板DNA与引物通过碱基互补配对结合,形成引物-模板复合物;
(3)中温延伸:在体系温度升高至70℃时,单链DNA模板-引物结合将会被DNA聚合酶识别,并在耐热DNA聚合酶的作用下,按照碱基互补配对原则,以四种dNTP为原料从5’到3’方向合成一条新的与单链模板DNA链互补的DNA链,从而形成一条新的含有目的片段的双链。
以上三个步骤的反复进行,便能使得目标DNA片段扩增数以指数形式上升。每个循环大概3 min,应以一般2~3 h就可完成30~40次热循环,产物量能达到起始模板量的230倍以上。
1.1.2 PCR技术存在的问题
PCR常见问题主要有出现假阴性、假阳性以及非特异性或涂抹状条带。PCR反应体系主要由DNA模板、引物、dNTP、DNA聚合酶以及反应缓冲液等组成,且反应过程中有高-低-中温的热循环,故PCR反应的结果主要受到这些因素的影响:
(1)假阴性,即不出现扩增条带。具体原因可能在模板DNA的制备、引物的特异性、酶的活性以及PCR热循环的条件中。①模板:可能是由于模板没有纯化,含有杂质蛋白或者DNA聚合酶抑制剂等。②引物:引物结构、引物浓度、两条引物不匹配也是产生假阴性的常见原因。③酶:若是DNA聚合酶失活则需换上新酶,也可以通过新旧两种酶同时使用,根据具体情况分析产生假阴性的情况是不是因为酶的活性不够或酶已经完全失活。④PCR循环条件:DNA的变性是PCR扩增中十分重要的一环,若变性温度过低,或变性时间过短都会导致模板DNA解链不完全,从而出现假阴性导致PCR失败;若退火温度过低,可能会产生非特异性扩增,降低特异性扩增效率,退火温度过高,将会降低模板与引物的结合率,降低PCR扩增效率,使扩增不出目标条带。
(2)假阳性,即出现的PCR扩增条带与目的条带一致,有时其条带亮度更高。可能的原因有:①引物设计不合理,使扩增出的PCR产物为非目的DNA片段。②模板DNA与扩增产物的交叉污染,互相拼接,与引物碱基互补配对后,扩增出PCR产物,出现假阳性现象。
(3)出现非特异性扩增带
PCR扩增后出现的条带与预计的大小不一致,同时出现非特异性扩增带与目的条带。非特异性条带的出现的原因有很多,一是扩增时出现引物二聚体或引物与模板DNA不完全互补;二是金属阳离子浓度过高,PCR循环次数过多;三是酶的质量问题,DNA聚合酶收到污染或加入的聚合酶过多都会出现非特异性扩增。
(4)出现片状拖带或涂抹带
PCR扩增有时出现片状带或涂抹带。产生这种现象的原因往往是加入的DNA聚合酶质量不好或加入量过大,dNTP浓度过高,退火温度过低,循环次数过多等。
1.1.3 PCR技术优化方法简介
PCR技术主要有三个特点:特异性、有效性和保真性。特异性是指PCR反应只扩增目的序列;有效性是指经过相对较少的PCR循环就能获得足够的PCR产物;保真性则是指PCR扩增产物与原始模板序列一致,几乎没有碱基掺入错误。理想的PCR反应应该具有高特异性、高保真性以及高效率,但在实际情况下,这三个特点都会受到PCR的反应体系或反应条件的影响,使得PCR反应结果与理想状况并不一致。因此,我们在进行PCR扩增时,需要寻找最优条件,或加入一些PCR反应促进剂,对PCR反应进行优化,从而提高其反应特异性、扩增效率、保真性等。
- 模板核酸
模板核酸在应用之前需要纯化,除去其中的核酸酶、DNA聚合酶抑制剂、蛋白酶以及能够与DNA结合的蛋白质[3]。实验表明,要想获得最好特异性的扩增应该只向PCR反应体系中添加单一的模板DNA,但这样PCR产量较低。在一定范围内,PCR的产量是会随着模板浓度的升高而明显增大,因此,为了获得较高产量同时保证较高的特异性,通常在PCR反应中,DNA模板加入量为102~105拷贝的靶序列[4]。以基因组DNA和质粒DNA为模板时扩增的最佳条件是不一样的,质粒DNA在PCR反应中需要的循环数少、酶量少、温度范围较大。
- 引物
引物是指人工合成的可以引发新DNA合成的比较短的单链DNA片段,一般取自模板DNA两条链的3’端相向长度在16~25 nt的单链DNA片段[5]。为了提高PCR的特异性,减少引物与模板之间的非特异性结合,引物序列一般会在基因的内含子区域选择。引物的设计一般由下列原则[6]:①引物长度常用为20 nt左右。②两引物之间的碱基对长度,一般PCR的扩增长度需要小于1000 bp。③引物碱基,C G的含量最好在40~60%,C G含量过低常常会导致扩增效率下降;C G含量过高则容易产生引物的非特异性结合,从而产生非特异性扩增。④避免两条引物之间形成较长的互补碱基的情况,防止出现引物二聚体。⑤引物3’端的碱基,应与靶序列完全配对,以防PCR扩增失败。⑥引物3’端最好是T或G,DNA聚合酶由T或G引发新链合成的效率要比由C或A引发的要高 [7]。⑦设计引物时要加上合适的酶切位点。⑧引物要有特异性。且在PCR反应体系中浓度要适当。
- 反应缓冲体系
Tris-HCl缓冲液是PCR体系中目前最常用的缓冲体系,通常缓冲液中会加入KCl(浓度低于50 mmol/L)、小牛血清白蛋白或明胶等以保护耐热DNA聚合酶。
(4)二价阳离子(Mg2 )
二价阳离子可以提高耐热DNA聚合酶的活性。其中,Mg2 的作用最好[8]。但反应体系中若Mg2 浓度过高,会使PCR反应的非特异性扩增加强;过低,又起不到很好地酶催化的作用。此外,Mg2 可与PCR反应体系中的一些DNA片段上的磷酸基团结合,从而使体系中游离Mg2 的浓度降低,但是耐热DNA聚合酶需要的是游离的Mg2 ,因此PCR体系中我们常常需要预先做浓度梯度实验,以确定该PCR反应体系的最适Mg2 浓度。
- 耐热DNA聚合酶
耐热DNA聚合酶是PCR反应中关键性的一环,因此耐热DNA聚合酶的选取和用量非常重要。目前有两种耐热DNA聚合酶在PCR反应体系中应用最广,一种是从栖热水生杆菌中提纯的天然酶,另一类为利用大肠菌合成的基因工程酶。他们的特点是具有高温稳定性、高催化活性、反应保真性、逆转录活性以及非模板依赖的聚合活性,这些特性使Taq pol酶在PCR反应中应用的最多。但同样,我们常用的耐热DNA聚合酶没有矫正阅读功能,在扩增过程中常常会引起碱基错配,因此,为了提高耐热DNA聚合酶的保真性,在体系中我们通常用的dNTP浓度较低、且复性温度要选择低于55℃。
- 反应温度与时间
PCR反应由高温变性-低温退火-中温延伸三个步骤组成。三个过程的温度都对PCR反应有重要影响。变性温度,它取决于DNA聚合酶的热稳定性以及模板DNA分子中的碱基对比例,变性时间,一般与模板DNA链的长度有关。目前较为常用的变性温度和时间为95℃、30s。在实际情况中,我们应根据耐热DNA聚合酶的稳定性、模板DNA的碱基对的比例和模板DNA链的长度适当地对变性的温度和时间进行调整。退火温度,取决于引物的长度、碱基组成和浓度。如果退火温度较低,PCR反应的敏感性会提高但特异性差,如果退火温度较高,虽然提高了PCR反应的特异性,但同时也降低了扩增效率。一般合适的退火温度低于引物Tm值5 ℃左右。在实际情况中,我们常用设置平行反应的方法优化退火温度。延伸温度,取决于所用耐热DNA聚合酶的最适作用温度,一般为70~75 ℃。在最适作用温度下,耐热DNA聚合酶活性较高可使体系中碱基掺入率最大。实验表明,当使用Taq DNA聚合酶时,通常延伸温度设定为72 ℃[9]。延伸时间则取决于待扩增DNA片段的长度,片段较短的1min左右即可,片段较长时,则需要相应延长一点时间。且在PCR的最后一轮循环中,适当将延伸时间延长4~10分钟,提高PCR扩增产量。
- 热循环次数
PCR反应的循环次数取决于模板DNA的初始浓度。PCR反应后期会出现平台效应,扩增产物的增加趋于停止。一般目的片段的最终复制数达到1012,PCR就不再以指数形式扩增.许多实验室研究了PCR反应中不同DNA聚合酶的效率,从而确定相应的热循环次数。
1.2氧化石墨烯概述
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: