Ni对HCS MM制备Mg-Al合金脱氢性能的影响及其机理毕业论文
2020-04-15 21:52:51
摘 要
镁基合金被认为是未来最理想的固态储氢材料之一,但其动力学缓慢和热力学稳定,严重制约了其在储氢领域的应用。采用氢化燃烧合成法制备Mg-Al合金可以原位生成具有优异性能的氢致Al*,其分布均匀、颗粒尺寸小、化学活性高。但是Mg-Al合金的脱氢性能仍高达360 ℃。本课题选择Ni作为催化剂以进一步改善Mg-Al合金的的储氢性能。本课题采用氢化燃烧合成法(HCS)制备Mg90Al10合金,并在此基础上通过机械球磨(MM)分别添加微米Ni和纳米Ni,旨在研究不同类型的Ni及添加工艺对Mg-Al合金的脱氢性能的影响,并探究Ni的催化机理。
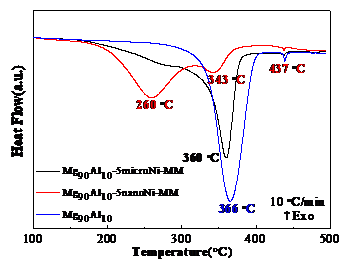
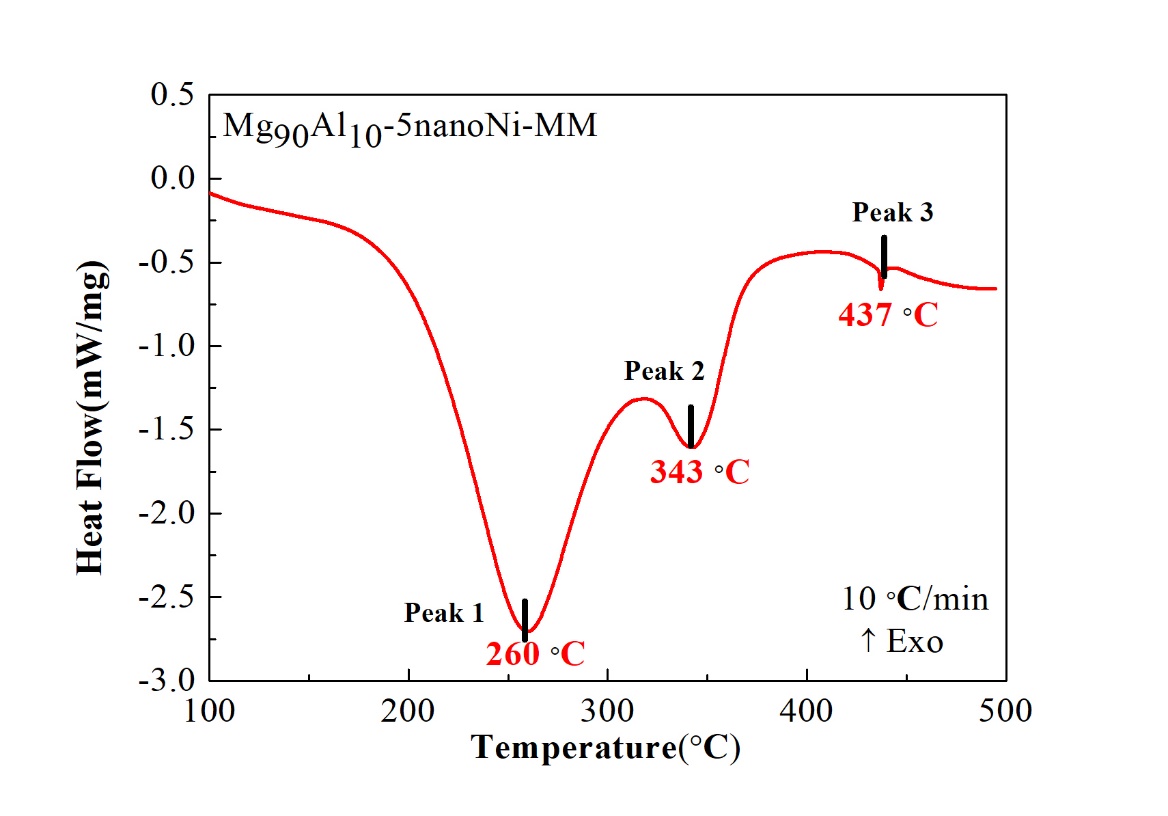
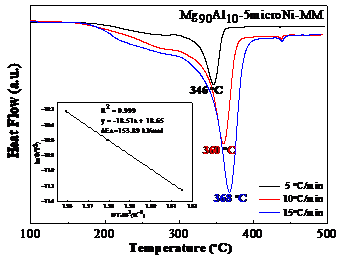
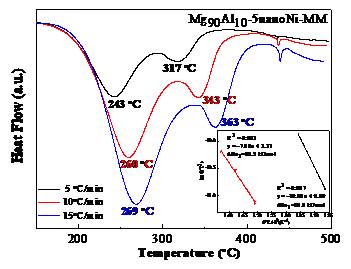
结果表明,通过机械球磨添加纳米Ni的Mg90Al10合金脱氢峰值温度为260 ℃和343 ℃,表观脱氢活化能为88.8 kJ/mol和65.5 kJ/mol,且样品主要在低温处脱氢。而通过机械球磨添加微米Ni的Mg90Al10合金脱氢峰值温度为360 ℃,表观脱氢活化能为153.9 kJ/mol。随着纳米Ni添加量的增加,脱氢峰值温度逐渐降低但幅度不大,添加过多会导致理论储氢量的损失。因此添加5 %是合理的。球磨时间对样品的脱氢性能影响不大,球磨时间为5 h的样品脱氢峰值温度最低。纳米Ni比微米Ni具有更优异的脱氢性能,这归因于纳米Ni的颗粒尺寸小,与Mg-Al合金接触面积多,且氢分子较易在纳米Ni表面解离及扩散。
关键词:镁基储氢材料 镁铝合金 脱氢性能 氢化燃烧合成 机械球磨
Effect of Ni on Dehydrogenation Performance of Mg-Al Alloy Prepared by HCS MM and Its Mechanism
Abstract
Mg-based alloys are considered to be one of the most ideal solid-state hydrogen storage materials in the future, but their slow dynamics and overstable thermodynamic seriously restricts their application. The hydrogen-induced Al* is formed during the preparation of Mg-Al alloy by hydrogenation combustion synthesis (HCS) with excellent properties, which has uniform distribution, small particle size and high chemical activity. However, the peak dehydrogenation temperature of the Mg-Al alloy is still as high as 360 °C. We select Ni as a catalyst to improve the hydrogen storage performance of the Mg-Al alloy. In this paper, Mg90Al10 alloy was prepared by HCS. Then, micro-Ni and nano-Ni were added respectively by mechanical milling (MM) to study the effect of different types and addition process of Ni to the hydrogen performance Mg-Al alloy and explore its catalytic mechanism.
The results show that the dehydrogenation peak temperature of Mg90Al10-5nanoNi is 260 °C and 343 °C and the apparent dehydrogenation activation energy is 88.8 kJ/mol and 65.5 kJ/mol. In addition, the sample is dehydrogenated mainly at low temperature. The dehydrogenation peak temperature of the Mg90Al10-5microNi is 360 °C and the apparent dehydrogenation activation energy was 153.9 kJ/mol. As the amount of nano-Ni increases, the dehydrogenation peak temperature decreases gradually but slightly. Too much addition will result in the loss of theoretical hydrogen storage so adding 5% Ni is reasonable. Ball-milling time has little effect on the dehydrogenation performance of the samples and 5 h is the best. Nano-Ni has better catalytic effect than micro-Ni, which is attributed to the small particle size of nano-Ni that contacts more with Mg-Al alloy. Also hydrogen molecules are easily dissociated and diffused on the surface of nano-Ni.
KEYWORDS: Mg-based hydrogen storage material, Mg-Al alloy, dehydrogenation properties, hydrogenation combustion synthesis, mechanical millin
目 录
摘要 i
Abstract ii
第一章 文献综述 1
1.1引言 1
1.2 储氢合金概述 2
1.2.1储氢原理 2
1.2.2金属储氢分类 2
1.3 镁基储氢材料性能改善 2
1.3.1合金化 3
1.3.2纳米化 3
1.3.3加入催化剂 4
1.3.4复合化 5
1.4 小结 5
第二章 实验方法 7
2.1实验材料与设备 7
2.1.1材料 7
2.1.2氢化燃烧合成设备 7
2.1.3球磨设备 8
2.2实验步骤 8
2.2.1预处理 8
2.2.2 氢化燃烧合成法制备Mg-Al合金 8
2.2.3 氢化燃烧合成产物与Ni进性机械球磨 9
2.3 材料性能测试 9
2.3.1 X射线粉末衍射 9
2.3.2 形貌表征 9
2.3.3差示扫描量热法与活化能的拟合 9
2.3.4储氢性能的测试 10
第三章 实验结果与分析 11
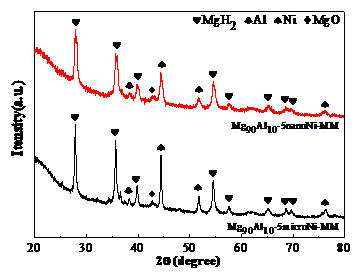
3.1通过机械球磨添加微米/纳米Ni对Mg90Al10的物相分析 11
3.2通过机械球磨添加微米/纳米Ni对Mg90Al10脱氢性能的影响 12
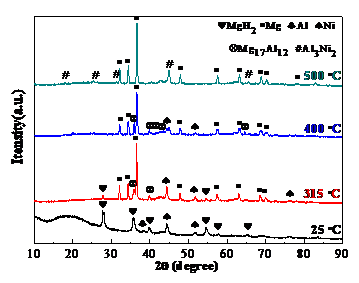
3.3纳米Ni的添加工艺对Mg90Al10脱氢性能的影响 18
第四章 实验结论与展望 20
4.1实验结论 20
4.2对未来研究工作的展望 21
参考文献 22
致谢 26
第一章 文献综述
1.1引言
在社会高速发展的今天,经济体量日益增长的同时也推动人类对能源需求的不断增加,从而导致大量化石能源的开采,而化石能源不仅会对环境造成严重污染,同时也是不可再生能源。因此,寻求能广泛应用于生产生活的清洁能源是当务之急。
氢能的发现,有望成为人类终极清洁能源,氢元素是地球上存在较为广泛元素。氢能主要具有以下四个优点:(1)氢的来源广泛。太空中含量最高的元素是氢,地球上的氢元素也非常丰富。(2)氢气的热值高。每千克氢燃烧后的热量约为汽油的3倍,酒精的3.9倍,焦炭的4.5倍[1]。(3)氢的燃烧产物无污染。(4)氢气的使用方式多种多样,既可以直接用作发动机燃料,也可以用于燃料电池发电[2]。如果再解决了氢气的无污染再生问题,氢能将会是人类使用的清洁能源。氢的生产到使用分为四步:氢气的生产、贮存、运送、利用。虽然氢气的生产和利用工艺在目前发展都比较完善,然而氢能的普及一直受制于氢气的存储。氢气储氢方式有主要分为三大类:气态存储、液态存储与固态存储。现有的气态存储方法中常用的是高压气态储氢,这种技术与我们现有的压缩天然气的原理相同,但由于氢原子质量小,消耗在储存容器的能量较多。在一个充气压力为20 Mpa的高压钢瓶中储氢重量占1.6%,供太空用的钛瓶氢重量也仅为5%[3]。同时气态存储对容器有很高的安全要求。液态存储技术常用的是低温液化储氢技术,该技术是在低温高压下将氢气液化,低温液化储氢的储罐容积一般较小,氢气质量密度为 10%[4],这种技术不仅要求存储容器的安全性,还要求容器的绝热能力。但这种技术还需解决保温过程所耗费的相当于液氢质量能量 30%的能量问题[5];另一种是有机液体储氢[6],这种方法往往伴随的副反应较多,制出的氢气纯度不理想。于是固态储氢材料渐渐走入我们的视野,固态储氢分为物理吸附型储氢方式[7]和化学储氢方式[8]这两种方式,其中物理吸附主要采用的是碳基纳米材料吸氢[9]。化学储氢种类分为配位氢化物[10]、金属氢化物[11];但配位氢化物储氢可逆性较差。而金属氢化物可以弥补气态、液态两种储存方式的不足的同时,并且具有储氢量大、可靠性高、可逆程度好等一系列优点,特别适合于移动储氢领域现阶段研究,如汽车,船舶方面。
1.2 储氢合金概述
1.2.1储氢原理
荷兰Philips公司和美国Broukhaven国立研究所分别发现了Mg2Ni[12],LaNi5[13],TiFe[14]等储氢合金的储氢特性,可逆的吸放和放出大量氢气。人们对储氢合金又有了一种新的认知。储氢合金的定义是由吸氢和放氢元素所组成,组成需要存在与金属合金相与氢化物相。在吸放氢过程,储氢合金产生热效应。吸氢过程出热,脱氢过程吸热。根据储氢合金的吸放氢特性,储氢合金需在降低温度或提高压力条件下吸收氢气,相反则在升高温度或降低压力条件下则放出氢气。
1.2.2金属储氢分类
金属储氢材料是按金属与氢的结合的稳定程度分为能生成稳定氢化物的金属元素A,与基本不生成氢化物的元素B共同组成。A元素主要是ⅠA-VB族金属,决定储氢量的大小,B元素主要是ⅥB-ⅧB族(Pd除外)过渡金属,此类金属起到控制吸放氢的可逆性的作用,同时也起到调节生成热和分解压的作用,根据A与B元素的比例不同,一般可分为AB5型(稀土型),AB2型(锆型),AB型(钛型),A2B型(镁型)和BCC(Body Centered Cubic)固溶体型等[15]。
1.3 镁基储氢材料性能改善
镁基储氢材料作为储氢材料具有以下优点:(1) 镁基材料储氢容量高,MgH2的储氢量达7.6 wt.%;(2) 储量丰富,价格适中。Mg约占地壳质量的2.35 %,Mg在海水中含量达到0.13 wt.% 。(3) 镁密度低,质量轻(ρ = 1.74 g/cm3);(4) 对环境污染小等[16]。然而,镁基储氢材料存在吸放氢温度高(MgH2起始脱氢温度为302 ℃ [17])、动力学性能差以及形成氢化物过于稳定等缺点,我们需要对其采取相应的方法对其进行改善。
现在改善镁基储氢材料性能使用较多的方法有(1) 合金化,(2) 纳米化,(3)加入催化剂,(4) 复合化。
1.3.1合金化
机械合金化在各种合金化方法中是改良镁基储氢材料性能最常用到的方法。其是将所需的金属粉末放在球磨机中,在惰性气体的保护下进行球磨,在球磨过程中会使不同的金属粉末合金化的同时引入大量缺陷,使得合金化后的镁基储氢材料优于未经球磨的镁基储氢材料吸放氢动力学。例如Ivanov E等[18]用机械合金化法制备出的Mg-Ni系金属获得了纳米晶等一些微观结构,制备出的产品具有良好的吸放氢动力学性能。另外Luo等[19]采用烧结的方法制备Mg(Ln,Y)三元金属固溶体得到Mg90Ln5Y5后进行加氢反应,得到MgH2、YH3、MgLn化合物;在脱氢还原后,除YH3都被还原为Mg(Ln,Y)固溶体。将Mg90Ln5Y5、Mg10Ln10、Mg进行加氢后还原反应焓测试,得到Mg90Ln5Y5分解反应焓为62.9 kJ/(mol H2),较Mg10Ln10降低5 kJ/(mol H2),较纯Mg降低12 kJ/(mol H2)。与Mg(Ln)二元固溶体相比,由Mg(Ln,Y)三元固溶体中得到的YH3在还原时起到催化剂的作用,起到降低还原温度、降低吸氢和脱氢的活化能。Zhu等[20]添加10 at.%Al进行压片研磨处理。在1.5 MPa氢气压力下加热到420 ℃,在340 ℃保温120 min后,Mg-10 at%.Al复合材料在氢化燃烧合成过程中能吸收6.34 wt.%H2,而未经处理的纯Mg粉氢化不明显。
1.3.2纳米化
纳米结构在合成氢化物过程中起着重要的作用。金属纳米粒子具有较小的尺寸和较大的比表面积,具有较低的熔点。此外,与微米尺度或大尺度样品相比,纳米粒子样品的颗粒尺寸较小,意味着在固-气-固反应过程中扩散距离较短,反应速度加快。Fichtner[21]总结出纳米氢化物表现出与宏观化学稳定性的不同,而稳定性主要取决于表面张力和摩尔体积等。在一个平衡的纳米氢化物体系中,反应可能会转移到吸氢或脱氢的一侧这取决于材料的大小和表面能;同时纳米晶具有更高的扩散系数,会增强吸氢脱氢的动力学性能。Paskevicius等[22]对氢化纳米镁的热力学性能进行研究,他们用机械化学法将纳米MgH2粒子嵌入到LiCl基体中,经测试得: ∆Hbulk=74.06±0.42 kJ/mol H2 变成∆Hnano=71.22±0.49 kJ/mol H2;∆H减少2.84 kJ/mol H2。∆Sbulk=133.4±0.7J/mol H2/K变成∆Snano=129.6±0.8J/mol H2/K);∆S减少了3.8 J/mol H2/K。另外Wang等[23]将二正丁基镁(MgBu2)溶液负载到有序介孔硅(SBA-15)的孔内,在5-10 nm的孔径范围内,经冷冻干燥和加氢处理,合成了纳米MgH2。在493 K 与6 MPa氢压下,SBA-15孔道内的MgBu2分解为MgH2。纳米MgH2的解吸温度降低到540 K,比商用MgH2降低了146K,与无处理从MgB2得到的MgH2相比降低了65 K。此外,对于孔径较小的SBA-15负载的MgH2,解吸温度更低。MgH2脱氢性能的改善归因于介孔二氧化硅的纳米限制。
1.3.3加入催化剂
在近些年的研究中发现由Mg、MgH2和少量过渡金属Ti、V、Mn、Fe、Co、Ni、Cu、Pd或过渡金属氧化物组成的复合材料的储氢性能,在不降低其高氢储容量的基础上降低了脱氢温度,从而其吸氢/脱氢动力学性能得到了改善。例如Jie Chen等[24] 采用单喷嘴静电纺丝技术制备了多孔镍纳米纤维(NFs),并对其进行了焙烧和还原。采用平均粒径为50 nm NFs催化MgH2。将MgH2与NFs球磨使MgH2表面均匀分布NFs。MgH2-4%Ni NFs起始放氢的温度143℃,放氢峰值温度是244℃。相比于MgH2的脱氢反应温度分别降低157℃和96℃,在325℃(7.02 wt%)时仅需11min即可完全脱氢。与纯MgH2相比,MgH2-4%NiNFs活化能明显降低到81.5 kJ/mol 。Lan等[25]研究用浸渍法制备Y2O3@rGO催化剂对Mg-Al合金储氢性能的改善。发现Mg-Al-Y2O3@rGO复合材料加氢温度和脱氢温度分别为102 ℃和122 ℃。添加5wt.%的Y2O3,在300 ℃下,Mg-Al合金加氢动力学参数从0.008提高到0.195。Mg-Al合金脱氢能垒为162.6 kJ/mol H2,Mg-Al-Y2O3@rGO脱氢能垒为145.9 kJ/mol H2;前者脱氢焓为70.7kJ/mol H2,后者为54.3 kJ/mol H2。所以Y2O3@rGO对Mg-Al合金加氢/脱氢热力学和动力学性能有明显改善。Mukesh Jangir等[26]研究过渡金属卤化物TiF4的催化作用,发现添加10wt.%TiF4的MgH2脱氢所需的活化能为70 kJ/mol,对比不做任何处理的MgH2和进行球磨处理的MgH2在脱氢所需的活化能分别降低了101 kJ/mol和67 kJ/mol。
1.3.4复合化
虽然合金化法能有效的改善Mg基储氢材料的吸氢/放氢动力学性能和温度,但Mg基储氢材料所需放氢温度仍高于250℃。有研究发现将镁基储氢材料与其他材料复合可以明显降低吸放氢温度。例如N. Juahir等[27]研究添加10 wt.%K2TiF6的MgH2-Li3AlH6,在第一和第二脱氢阶段的起始脱附温度分别为120 ℃和225℃,比未添加的MgH2-Li3AlH6分别降低了60 ℃和45 ℃。MgH2-Li3AlH6 10 wt.% K2TiF6的脱氢动力学也比未添加的样品有明显的改善。他们计算出添加10wt.% K2TiF6后,MgH2-Li3AlH6的表观活化能由原先的150kJ/mol降至133kJ/mol。在X射线衍射分析中,在MgH2-Li3AlH6 10 wt.% K2TiF6中,脱氢和再吸氢过程中形成了Al3Ti、LiF和TiH2的新相,促进了MgH2与Li3AlH6之间的相互作用,从而改善了材料的吸放氢性能。另一些研究则是将铝与Mg基材料复合研究其吸放氢性能。例如Li等[28]研究MgH2 2LiBH4中添加Al对储氢混合物吸放氢性能的影响。通过热重分析,该混合物在530 K左右开始脱氢,比MgH2 2LiBH4混合物的相应温度低80 K,并在773 K以下解吸9.5 wt.%的氢。说明添加Al形成的混合物可以提高脱氢动力学。Jiang等[29]研究不同的Al源(金属Al、LiAlH4及其分解产物)与Mg(BH4)2 复合而成的多种Mg-B-Al-H体系。发现不同铝源对Mg(BH4)2脱氢性能改善效果相似。以添加LiAlH4为例,该复合材料在140 ℃放氢,在300 ℃下的放氢量为3.6 wt.%;而单独的Mg(BH4)2在250 ℃放氢,300 ℃放氢量为1.3 wt.%。同时相同温度条件下放氢率达到90%时,前者速率比后者快40%。
1.4 小结
在固态储氢中,金属储氢研究较为广泛,而金属储氢中,由于Mg元素储量丰富,质量轻和环境友好。科研人员希望利用镁的这些优点希望开发出镁储氢材料,但由于镁的动力学和热力学问题一直制约其发展,现有的研究还达不到我们所期望的要求。因此此,我们希望利用其他金属的特性来对镁进行改良,新的工艺对镁基储氢材料改良,以达到我们对镁储氢材料的期望。
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: