TiC-Cu复合材料在氩气和空气气氛下的热爆炸反应行为外文翻译资料
2023-02-26 20:25:56

英语原文共 10 页,剩余内容已隐藏,支付完成后下载完整资料
TiC-Cu复合材料在氩气和空气气氛下的热爆炸反应行为
摘要:本文研究了不同铜含量的Cu-TiC体系在空气和氩气(Ar)下的热爆炸反应行为。在两种气氛下,铜含量的增加会使体系的引发温度升高,最高温度降低。在空气条件下体系的引发温度远低于Ar条件下的引发温度,但两种条件下反应得到的复合材料的微观结构和相组成相似。这是因为,在空气作用下,致密表面上的钛的氧化、氮化和铜的氧化会降低引发温度,溶解度-扩散-沉淀机制导致TiC的形成过程在空气中与Ar下相同。
关键词:陶瓷的;金属基复合材料;SEM;X射线衍射;氧化
0 引言
陶瓷材料如硼化物、氮化物和碳化物等,因其特殊的硬度、耐腐蚀性和高温稳定性而成为高级结构应用的天然候选材料[1],在实际生产中得到了广泛的应用。Wu等[2]人制备了具有良好耐腐蚀性的TiC颗粒增强304不锈钢。Shi等[3]人制备的含5 wt.%钴的Al2O3-TiC复合材料在高达800-1000℃的温度下表现为高的抗氧化性能,但由于强共价键和低的自扩散系数,该材料固结困难[4]。为了解决这一问题,人们采用了反应热压、强夯、放电等离子烧结、暂态塑性相处理等多种技术[5],然而,由于时间、经济和效率的原因,大多数工艺在实际生产中并没有得到广泛的应用。
与上述工艺相比,燃烧合成(CS)由于具有简单、经济、高效等优点,成为人们制备致密、高强度的陶瓷基复合材料[6]的一个强有吸引力的选择。CS一般有自蔓延高温合成(SHS)和热爆炸(TE)两种方式,两种方法分别是通过加热反应物致密体一端和整个反应物致密[7]来引发。钛与碳粉在真空或Ar气氛下通过TE反应制备TiC陶瓷的过程中,由于体系的引发温度很高,甚至接近钛的熔点,从应用的角度来看,传统的加热炉不能提供足够的热量来引发TE反应,这限制了TE技术的广泛应用。为此人们引入低熔点的第二种金属,如Cu、Al、Ni、Fe[8 15],通过形成低熔点的金属间化合物并在低温下演化成液体来降低引发温度,从而改善质量转变[9]。在这些元素中,Cu不仅可以促进CS反应的发生,而且Cu作为添加剂,改善了反应物的结构性能。在Ti和C反应物中加入Cu可以使其引发温度大大低于Ti的熔点。遗憾的是,在真空或Ar气氛下,TE反应的引发温度仍然过高,不能用于工业[16]。到目前为止,一些陶瓷,如TiN, NbN和ZrN[17 20],已经成功地通过N2和选定的金属反应物之间的持续放热反应制备出来。一方面,气固反应产生的热量有利于降低CS反应的引发温度。另外,复合材料与表面空气发生反应产生热量,Cu-TiC系统的TE反应的引发温度在空气气氛下可能会降低,进而促进TE反应的发生。但因此可能会形成一些杂质,如钛的氧化物和氮化物,若除去杂质后,在TE反应产物中只存在TiC和Cu。
因此,为了研究Cu-TiC体系在空气和Ar气氛下的TE反应行为和反应产物,我们进行了相关实验,并且同时考察了反应产物的引发温度和纯度。采用差热分析法(DTA)和淬火试样对反应行为进行了研究,对在空气中制备的反应物进行了微观结构表征,并与在Ar气氛中制备的反应物进行了比较,这将会促进TE技术的发展和应用。
1 实验过程
实验采取的原料分别为铜粉(99.5%纯度~6mu;m)、钛粉(99.5%纯度~25mu;m)和碳粉(99.9%纯度~38mu;m)。研究对象为Ti与C摩尔比为1:1的Cu-TiC体系。为了研究铜含量对TE反应行为和产物纯度的影响,铜含量在混合物总重量的10 ~ 50 wt.%之间变化。反应物粉末混合在一个不锈钢容器中,使不锈钢球速度低于35 rpm/8 h以确保同质性,然后被压制成紧凑圆柱体(直径约22毫米,长为12plusmn;2毫米长度),以达到其密度理论密度的65plusmn;2%。制备完成后,将粉盒放入石墨模具中,分别置于空气和Ar气氛下的10kw电阻加热炉中,以40℃/min的速度对所有的圆柱形容器进行加热,使其达到TE反应的引发温度。加热过程中,用W-Re5/W-Re26热电偶测量样品中心附近的温度,数据采集系统以50ms /point的采集速度记录并处理信号,绘制温度时间曲线。
另外,采用差分热分析(DTA, Rigaku-8150, Japan)实验研究了不同铜含量的粉末混合料在流动氩气(流速为60mu;m /min)和空气中反应的引发过程,升温速率为40c /min。DTA反应的温度校准采用40℃/min的铜(氩)标准。每个DTA数据取自三个并行测试的平均值。为了研究TE过程中相变的顺序,对燃烧前的试样进行了淬火。对淬火后的试样进行抛光和腐蚀,并进行了相分析和组织演变表征。采用扫描电子显微镜(SEM)(日本JSM-5310型)和能量色散光谱(EDS)
(英国Link-Isis型)对样品的形貌和微观结构进行了检测。利用X射线衍射(XRD)对TE反应和DTA产物的相组成进行了表征(D/Max 2500PC Rigaku, Japan)。
2 实验结果
2.1 燃烧过程和相组成
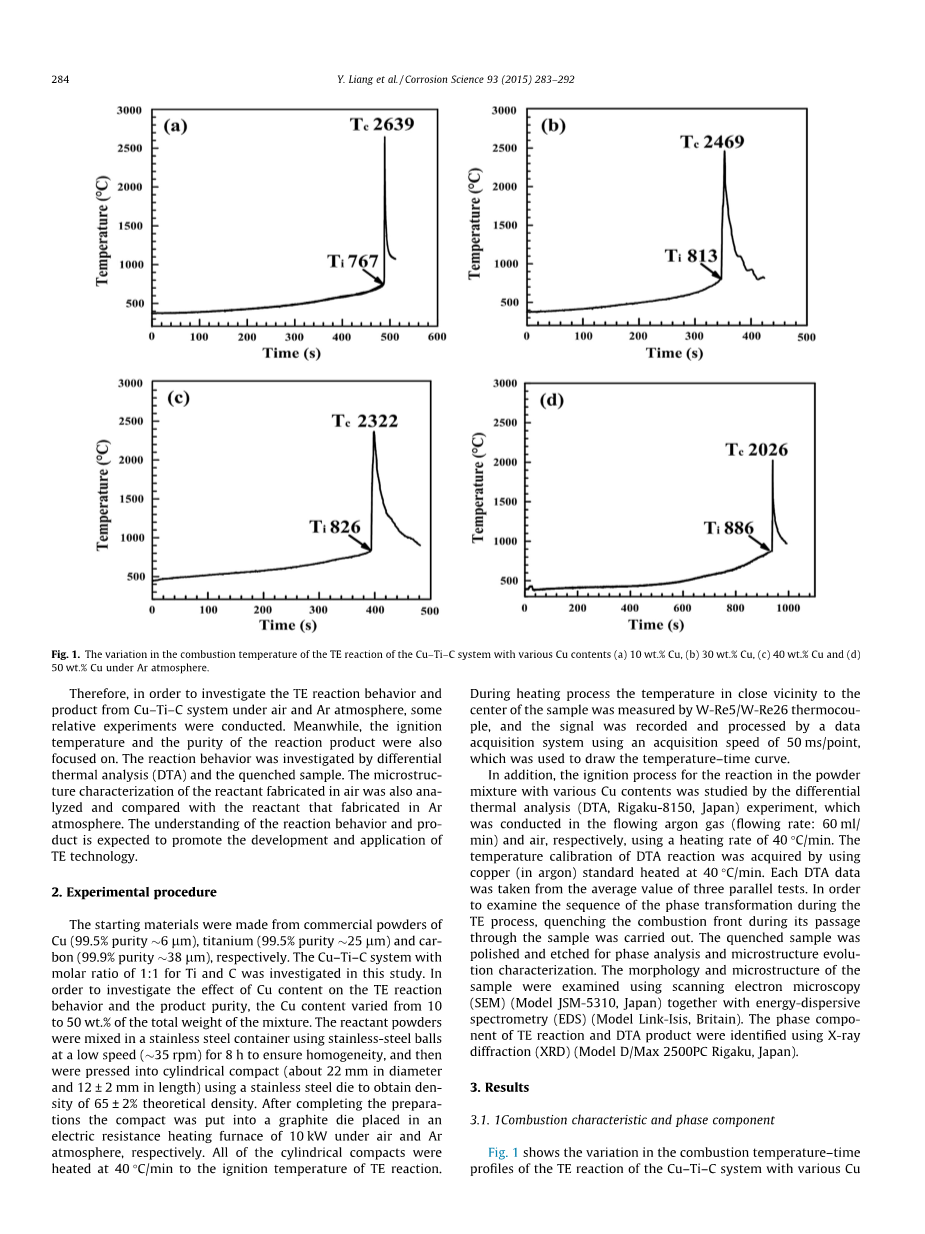
图1为不同Cu含量的Cu-TiC体系在Ar气氛下TE反应的燃烧温度时间分布图。我们把从加热开始到TE反应开始之间的时间间隔定义为引发时间,引发时间的长短表征了反应是否容易发生。但是,由于测量过程中初始温度的差异,本研究没有考虑引发时间。在此期间,由于发生放热反应和燃烧波的传播,使致密体的温度迅速升高,我们将临界温度定义为引发温度(Ti),放热反应的最高温度定义为最大燃烧温度(Tc)。结果表明,如图1所示,当Cu含量从10 wt.%增加到50 wt.%时,Ti从767℃增加到886℃,Tc从2639℃减少到2026℃。随着铜含量的增加,Tc降低,单位时间内热损失率降低。当铜含量从10wt .%增加到50wt .%时,反应产热和燃烧温度降低,温度下降导致热损失率低。
图2为不同Cu含量的Cu-TiC体系在空气中TE反应的燃烧温度-时间分布图。可见,当Cu含量从10 wt.%增加到50 wt.%时,Ti从544 ℃增加到595℃,Tc从2547℃减少到2231℃。可以看出,随着Cu含量的增加,引发温度和最高温度的变化与图1相同。和图1相比,我们可以清楚地看到,空气中的引发温度(544℃,556℃,577℃,595℃)是(223℃,307℃,249℃,291℃)比在Ar气氛下的(767℃,863℃,826℃,886℃)相对来说要低。这一现象表明,铜-钛化碳体系在空气中的TE反应比在Ar气氛中容易进行。
图3(a)显示了在空气和Ar气氛下,Cu含量为30%的Cu-TiC致密物的外观。我们可以清楚地看到Cu-TiC致密物表面颜色的差异。从图3(c)可以看出,与Ar中的反应致密相比(图3(b)),在空气中的反应物致密表面有一层厚度为0.16 mm的黄白色层,与Ar大气中的不同,反应后的黄白色层非常脆弱,很容易被刮掉。图3(c)明确证实了该反应层的存在,从图3(b和c)可以看出,与在Ar气氛中生成的TE产物的显微图相比,在空气中生成的反应后的Cu-TiC致密体的内部没有太明显的区别。
为了确定空气中TE产物内部的相组成是否与Ar中相同,我们进行了XRD实验,结果如图4所示。XRD分析结果表明,反应后的黄白色层主要由TiO2、TiN、CuO、Cu、C组成,如图4(b)所示。与空气中形成的致密表面相比,同一样品的内部没有形成大量的钛氧化物和氮化物。图4(a)分别为10 wt.%、30 wt.%、40 wt.%和50 wt.%的Cu-TiC体系TE产物的XRD结果。结果表明,在10 wt.%、30 wt.%、40 wt.%和50 wt.%的Cu-TiC体系中,产物由TiC和Cu组成,没有中间相,反应完全。XRD结果表明,在空气中发生TE反应的制品中存在大量的碳化钛和铜。如图4所示,这与Ar中得到的产物相同。其中,反应物的黄白层的白色为Ti的氧化物和氮化物,而黑色为Cu的氧化物(图3(c))。在不同的Cu含量和XRD相下,两种气氛下的TE产物没有太大的差异,这表明TE反应在低温空气中成功发生,且产物内部没有任何如钛的氧化物、氮化物和铜的氧化物的杂质。
图5分别为铜含量在10 wt.%、30 wt.%和50 wt.%分别在Ar气氛中和铜含量30 wt.%在空气中制备的Cu-TiC体系TE产物的微观结构。从图5(a) (c)可以看出,TiC粒子呈现典型的球形或圆形。当Cu含量从10 wt.%增加到50 wt.%时,TiC颗粒数量减少,颗粒尺寸明显减小。关于这一现象的更多详细解释在文章[21]中给出。图5(d)中也可以观察到典型的球形TiC颗粒。与图5(b)相比,30 wt.% Cu在Ar和空气中生成的Cu-TiC体系的TE产物在粒子形貌上没有太大的差异。通过空气中Cu-TiC体系的热爆炸反应,成功地制备了Cu-TiC复合材料。然而,为了了解Cu-TiC致密表面的引发行为和燃烧过程,分别在Ar和空气中进行了DTA实验。
2.2 热分析
图6展示了当以40℃/min加热到1200℃时,不同铜含量的Cu-TiC体系的DTA曲线和产物XRD图谱。虽然我们从DTA实验中得到的信息并不完整,但是对于我们了解不同Cu含量的Cu-TiC体系的反应过程是有价值的。实验以30 wt.% Cu在Ar中生成的TE产物为对照,研究了空气和Cu含量对反应行为的影响。在实验过程中,我们可以清楚地看到在Ar气氛下铜含量为30 wt.%的Cu-TiC体系中,大约899℃、990℃、1040℃为三个强放热峰的峰值,1021℃为一个吸热峰的峰值。在10 wt.% Cu-TiC 体系加热到1200℃,在DTA曲线上可观察到在416℃、484℃、627℃、1110℃存在四个放热峰,此外,除了四个放热峰,在该DTA曲线中没有发现吸热峰。如图6(a)所示,在空气气氛下加热到1200℃,320℃,482℃,758℃,1088℃为体系分别的四个放热峰峰值,且结果表明,该DTA曲线不存在吸热峰。从Cu含量为50 wt.% 的Cu-TiC体系在空气中的DTA曲线我们可以发现,除在320℃、469℃和775℃存在三个放热峰外,在大约1114℃还存在一个吸热峰。
正如图6(b)所示,根据Cu-TiC体系DTA产物的XRD图谱,除了能观察到大量的TiC以外,也可以看到少量的C,Cu和TiCu4,这意味着Ti和C转化为TiC的过程尚未完成,这可能是由于DTA样品体积小,所以反应产生的热量更容易消散到周围,导致反应不完全。正如图6(b)所示,不同铜含量的Cu-TiC体系在空气下进行TE反应的产品的XRD图案包括TiO2,CuO,Cu和TiN以及少量的C。值得注意的是,在空气条件下不同Cu含量的Cu-TiC体系的XRD图谱中均未发现TiC。
图7研究了铜含量为30 wt.% Cu-TiC体系在不同温度下的DTA产物的XRD图谱,这对了解Cu-TiC在空气中致密化反应的反应机理有一定的参考价值。当30 wt.% Cu-TiC体系加热到320℃时,除未反应的铜、钛、C粒子外,还发现了大量的Cu2O。因此对于30 wt.% Cu-TiC体系,当温度升高到320℃时,Cu与O之间首先发生氧化反应生成CuxOy。当温度升至420℃时检测到大量的CuO生成,这表明随温度升高,Cu2O与O2发生进一步反应,形成更稳定的CuO相。因此,图6(a)DTA曲线上484℃的放热峰表明铜含量为30 wt.% Cu-TiC体系在空气中的反应等同于Cu2O的氧化反应。然而,这种反应仍然很弱。当温度上升到758℃时,在XRD图谱中检测到大量的TiN0.3和TiO2颗粒。如图6(a)所示,钛的氧化氮化反应和铜的氧化反应所产生的热量导致最大放热峰在758℃。该放热反应的强度远高于同一曲线上的其他反应,这可能是由多个放热反应连续发生组合所致。当温度上升至1088℃时,TiN0.3和N2之间可能会发生进一步的反应,形成更稳定的TiN相。根据XRD衍射图,Cu2O中间相消失了,这表明Cu2O和O2完全反应生成CuO。这种燃烧阶段的出现是由于TiN化合物的形成,这是一个放热反应,在DTA曲
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[234093],资料为PDF文档或Word文档,PDF文档可免费转换为Word




