活性氧自由基响应胶束的制备研究毕业论文
2020-06-30 21:12:10
摘 要
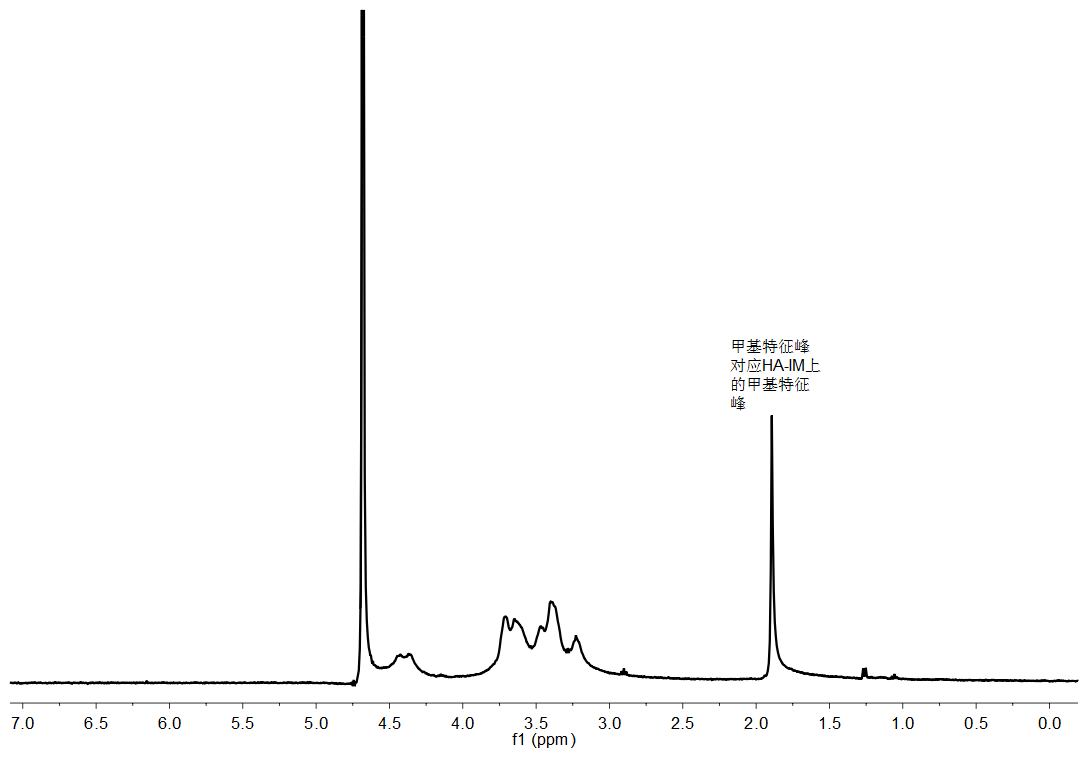
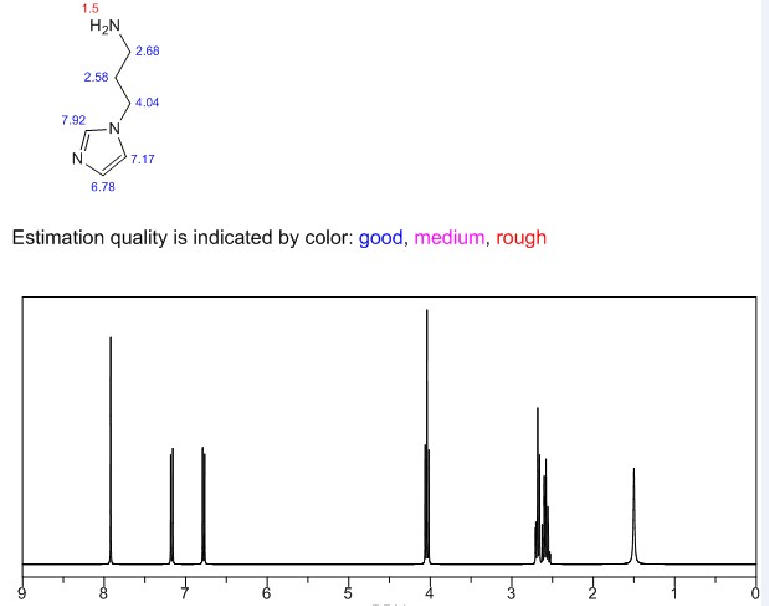
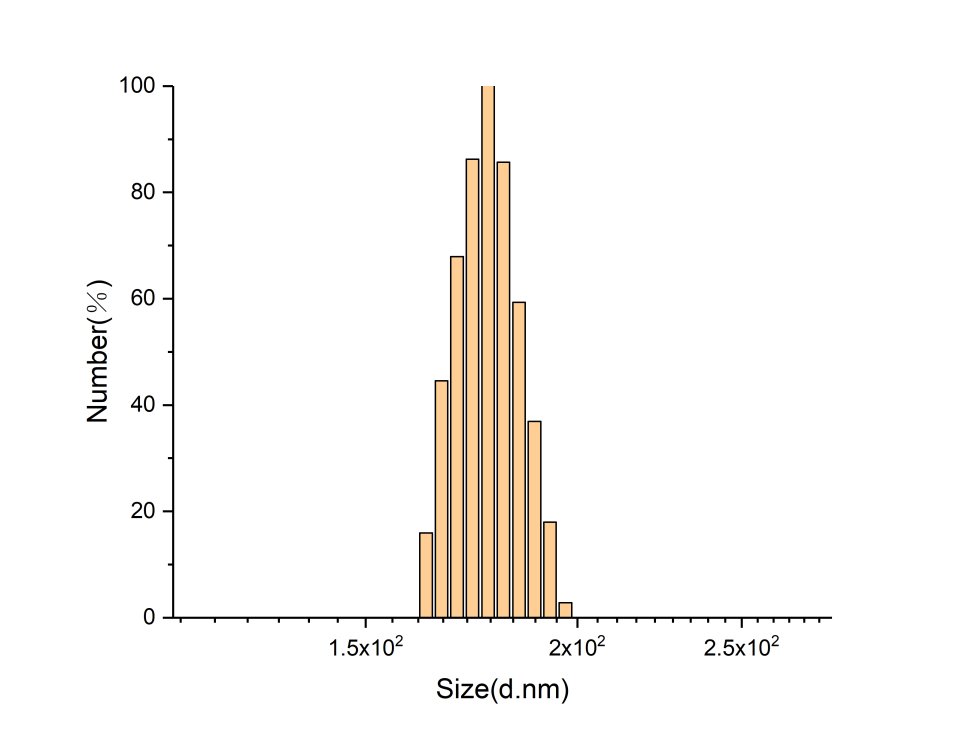
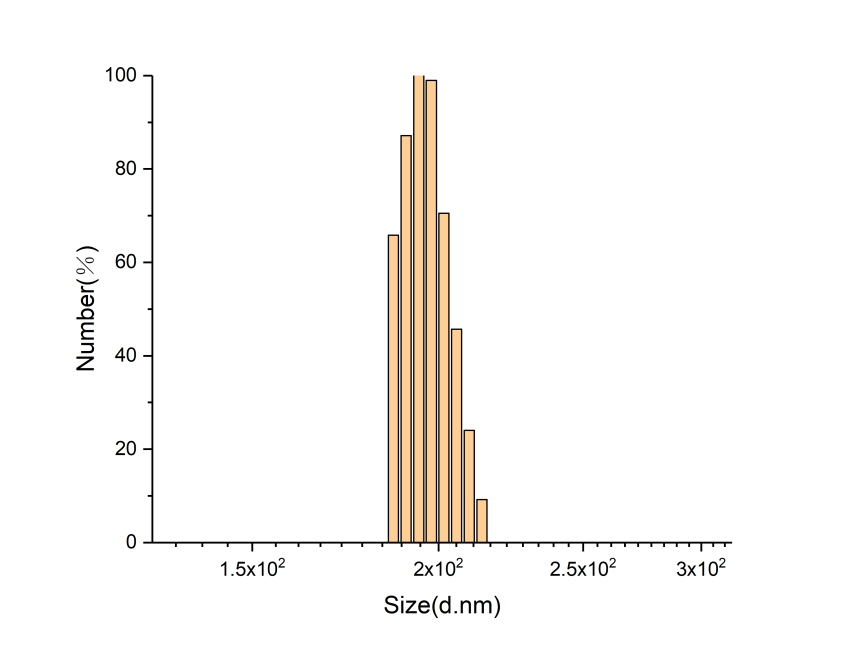
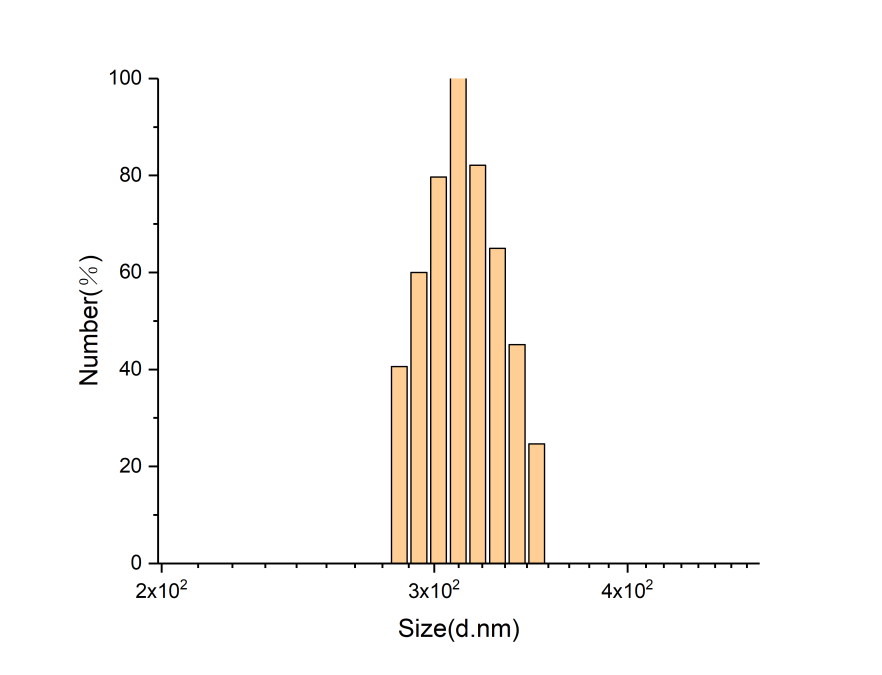
目的:通过酰胺化反应,合成咪唑修饰的透明质酸HA-IM(HA-IM),再通过透析的方法制备成胶束。主要用来实现药物在活性氧自由基环境下的释放。方法:考虑到咪唑修饰的透明质酸是否会影响药物的释放来制备HA-IM,再通过核磁共振氢谱分析和NanoBrook Omni纳米粒径及zeta电位分析仪检测产物的接枝率和粒径,最后经过过氧化氢破坏验证ROS响应性。结果:通过核磁共振氢谱分析检测所制备的咪唑修饰的透明质酸的接枝率39%,通过NanoBrook Omni纳米粒径及zeta电位分析仪检测的有效粒径为391.15nm。
结论:设计的咪唑修饰的透明质酸的衍生物是一种合适的可以实现药物在活性氧自由基环境下的释放的材料。
关键字:活性氧自由基 胶束 药物释放
Preparation of reactive oxygen radicals reactive micelles
Abstract
OBJECTIVE: To synthesize imidazole-modified derivatives of hyaluronic acid (HA-IM) by amidation, and to prepare micelles by dialysis. It is mainly used to achieve the release of drugs in the active oxygen free radical environment. METHODS: Considering whether the imidazole-modified hyaluronic acid affects the release of the drug, HA-IM was prepared, and then the product was grafted and examined for particle size by nuclear magnetic resonance spectroscopic analysis and NanoBrook Omni nanoparticle size and zeta potential analyzer. ROS responsiveness was verified by hydrogen peroxide disruption.RESULTS: The grafting rate of imidazole modified hyaluronic acid prepared by NMR analysis was 39%, and the effective particle size was 391.15nm by NanoBrook Omni nanoparticle diameter and zeta potential analyzer.Conclusion: hyaluronic acid derivative modified imidazole is a suitable design of the released drug materials in the environment of reactive oxygen species can be achieved.
Key words: reactive oxygen radical; micelle; drug release
目录
摘要 I
Abstract II
第一章 绪论 1
1.1ROS响应及响应载体介绍 1
1.2含硫醚聚合物ROS响应载体 2
1.3含硒化合物或含碲化物的聚合物ROS响应载体 4
1.4含芳基硼酸酯的聚合物ROS响应载体 4
1.5课题探索 5
第二章 实验部分 7
2.1试剂与耗材 7
2.2实验仪器 7
2.3两亲性聚合物的合成 7
2.4两亲性聚合物表征 8
2.5胶束的制备 9
2.6 NanoBrook Omni纳米粒径及zeta电位分析仪粒径分析 9
2.7 ROS响应验证 10
第三章 结果与讨论 11
3.1核磁氢谱分析 11
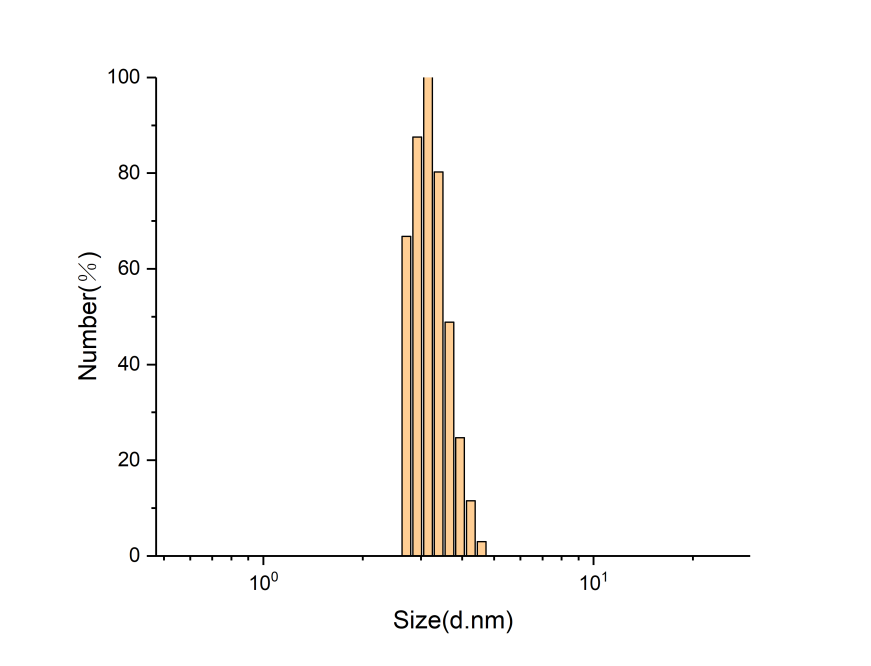
3.2粒度仪分析 13
第四章 总结 17
参考文献 18
致谢 21
第一章 绪论
1.1 ROS响应及响应载体介绍
近几年,药物递送系统[1](DDSS)的设计已经吸引了越来越多的关注,因为DDSS能够有效地向患者提供多种治疗药物疾病部位。然而,治疗结果通常是受非特异性药物释放和快速血浆消除的限制,这不仅需要药物剂量的增加,而且带来不良的副作用。因此,刺激反应它们的位点特异性释放,DDSS是至关重要的。存在与刺激相关的刺激的能力[2]。典型生理刺激应用于DDSS包括内源性信号如ROS、氧化还原。电位、酸度、缺氧和酶,或外源信号如温度、光、超声响和磁场[3]。最受欢迎的生物刺激之一是ROS,因为它们在几种疾病中已经发生了过度生产。新兴的ROS敏感材料具有广阔的应用前景和生物医学发展的潜力。
典型的活性氧由超氧阴离子,过氧化氢和羟基自由基组成,以及其中之一活性氧自由基可以通过一系列反应转化为另一种活性氧自由基[4]。活性氧从NADPH酶或线粒体代谢以及通过光动力或非光动力作用产生。细胞内超氧化物主要是由NAPH氧化酶在NAPH氧化酶作用下的氧化(NOx)或来自线粒体有氧代谢的电子泄漏。同时,O2可以迅速转化为H2O2。通过超氧化物歧化酶(SOD)高浓度OH·与金属阳离子反应形成Fe2 、Cu 对细胞DNA、脂类或蛋白质造成不可逆转的损伤。此外,H2O2还可以转化抗氧化蛋白(PRX)、谷胱甘肽过氧化物酶(GPX)和过氧化氢酶[5]。ROS作为一个细胞中的双刃剑。低水平ROS起着重要作用在支撑作为细胞信号分子的细胞生命周期中,通过可逆地氧化蛋白质巯基,从而改性蛋白质的结构和功能。细胞有多种调节结构平衡的机制并消除ROS来控制它们处于中等水平。然而,不平衡会产生氧化应激。高水平的活性氧,导致细胞氧化,组织损伤(如DNA、脂质和蛋白质)、细胞凋亡或坏死,可能促进致癌突变[6]。大量证据表明:与癌细胞相比,癌细胞比正常体细胞具有更高的活性氧水平。
据报道,活性氧浓度在癌细胞中达100μm,约高于正常细胞的100倍[7]。许多癌细胞都是很好地适应氧化应激,因为它们固有的灵活性。在疾病部位的氧化还原状态与这种异常的生化变化激发了研究人员开发响应高水平ROS用于目标特定的DDSS。利用ROS敏感材料,许多ROS响应的DDSS已经被开发和调查出于治疗目的。此外内源性ROS、光敏剂或其他化学物质药物也可作为代表性外源物。ROS也是引起发药物释放的原因[8]。许多ROS敏感载体或前药被用于研究智能的DDSS的应用,包括含有硫醚、硒化物/碲化物、二硒化物的结构,硫代缩酮,芳基硼酸酯,氨基丙烯酸酯,寡聚脯氨酸,过氧酯和介孔硅[9-10]。根据这些链接药物的设计,主要的药物释放机制可归因于活性氧响应载体的溶解度,ROS响应载体的变化或ROS响应的前药变化[11]。
ROS响应性纳米载体在各个领域有着广泛的应用。ROS 响应性基团往往与多种抗肿瘤治疗方法联合应用达到最佳治疗状况。物理方面的联合应用主要包括 ROS 联合热力学、光动力学、超声波、放射性疗法等;生物学方面则主要包括 ROS联合细胞靶向、亚细胞器靶向、氧化还原双重作用等;化学方面则利用内涵体偏酸性、荧光物质发光等方面。
1.2 含硫醚聚合物ROS响应载体
含硫醚聚合物[12]是一种在生物医学研究中对ROS敏感材料最受欢迎的一种材料。 在存在氧化性条件下,含硫醚聚合物经历相变疏水性硫化物变成更亲水的亚砜或砜。 早在2004年,Hubbell的小组开发了ABA块由聚(乙二醇)(PEG)和聚-(丙烯硫化物)(PPS)用于设计ROS响应聚合物囊泡[13]。 用H2O2处理后,DDSs释放其有效载荷由于阶段不稳定过渡造成的。
相关图片展示: