Biimidazole推拉染料两种相互独立的传感途径同时检测Cu2 和Hg2 外文翻译资料
2022-12-21 16:48:34

英语原文共 10 页,剩余内容已隐藏,支付完成后下载完整资料
Biimidazole推拉染料两种相互独立的传感途径同时检测Cu2 和Hg2
NilanjanDey,dagger;Jiřiacute;Kulhánek,Dagger;FilipBureš,*,Dagger;andSantanuBhattacharya*,dagger;,sect;
印度理工学院有机化学系,班加罗尔560012,
印度有机化学与技术学院,帕尔杜比采大学化学技术学院,PardubiceCZ-53210,
捷克共和国印度科学培养协会主任研究单位,印度加尔各答700032
摘要:
设计了一种易于合成的双咪唑推拉染料,其包含两个相互独立的分析物结合位点。已经发现Hg2 通过噻吩残基与化合物配位并抑制电荷转移(CT)过程,其使黄色溶液变为无色。另一方面,在添加Cu2 时在CT带中观察到异常大的红移,伴随着颜色从黄色变为红色。机械研究得出了一个相当令人惊讶的观察结果,其中表明Cu2 催化6-亚氨基-5,6-二氢吡咯并[3,4-d]咪唑-4(3H)-酮(IPIMO)衍生物的形成。这强烈影响化合物的电荷转移状态及其极化率。最重要的是,这是第一份利用IPIMO形成反应来探测金属离子的报告。此外,该系统用于筛选废水样品中的这两种金属离子。回收率范围为93.3%至105.0%证实了本方法用于估计复杂基质中痕量金属离子的适用性。此外,使用纸条开发了廉价的现场检测系统。
简介:
用于检测有毒金属离子或生物相关分析物的基于小有机分子的光学探针在最近已经受到相当多的关注。对目标分析物的高灵敏度,快速响应,结构变化的广泛可能性以及简单的检测策略使得这些探针与其他传统分析技术相比成本低廉且用户友好。1然而,经典光学探针主要用于一对一识别策略,其中靶分析物的结合影响信号单元的光学行为。迄今为止,文献中仅出现了少数系统,其中单一化合物可通过产生可区分的光学信号同时检测多种金属离子。2毋庸置疑,这些分子传感器可以有效地减少分析现实样品(如生物液体或饮用水等)的时间和成本。
尽管需求巨大,但这种分子模块的设计具有挑战性,因为需要在同一分子中加入一个以上的正交相互作用位点。一种分析物的结合不会影响与另一种分析物的相互作用,甚至不会影响它们的添加顺序。3涉及“小化学反应”是开发此类多响应探针的“智能”策略之一(表S1)。4由于这些化学反应具有高度特异性的分析特性,因此接收假阳性结果的可能性很小。
本文中我们设计了一种推拉染料,其具有4,5-双[4-(N,N-二甲基氨基)苯基]咪唑作为供体部分,并且4,5-二氰基咪唑作为受体单元(图1c)。这种D-pi;-A体系的极化性取决于化学结构,特别是取决于供体和受体部分的电子特性,总体几何形状和pi;-共轭接头的长度。5因此,这些化合物作为发光二极管,光电子器件和有机光伏电池等的有源部件具有巨大的应用.6此外,将杂芳族化合物如苯并咪唑,噻唑,噻吩等引入发色团骨架中可增强染料的光稳定性以及它们的热稳定性和化学稳定性。7
在这项工作中,我们特别感兴趣的是探索化合物1在水性环境中的离子结合特性。在各种过渡金属离子中,化合物1显示出对Cu2 和Hg2 的选择性响应。金属离子Hg2 通过pi;-连接基的噻吩残基配位并减少分子内电荷转移(ICT)相互作用的程度。结果,黄色溶液在Hg2 存在下变为无色。然而,当化合物1加入Cu2 时,进行了完全不同的观察,其中CT显着红移。
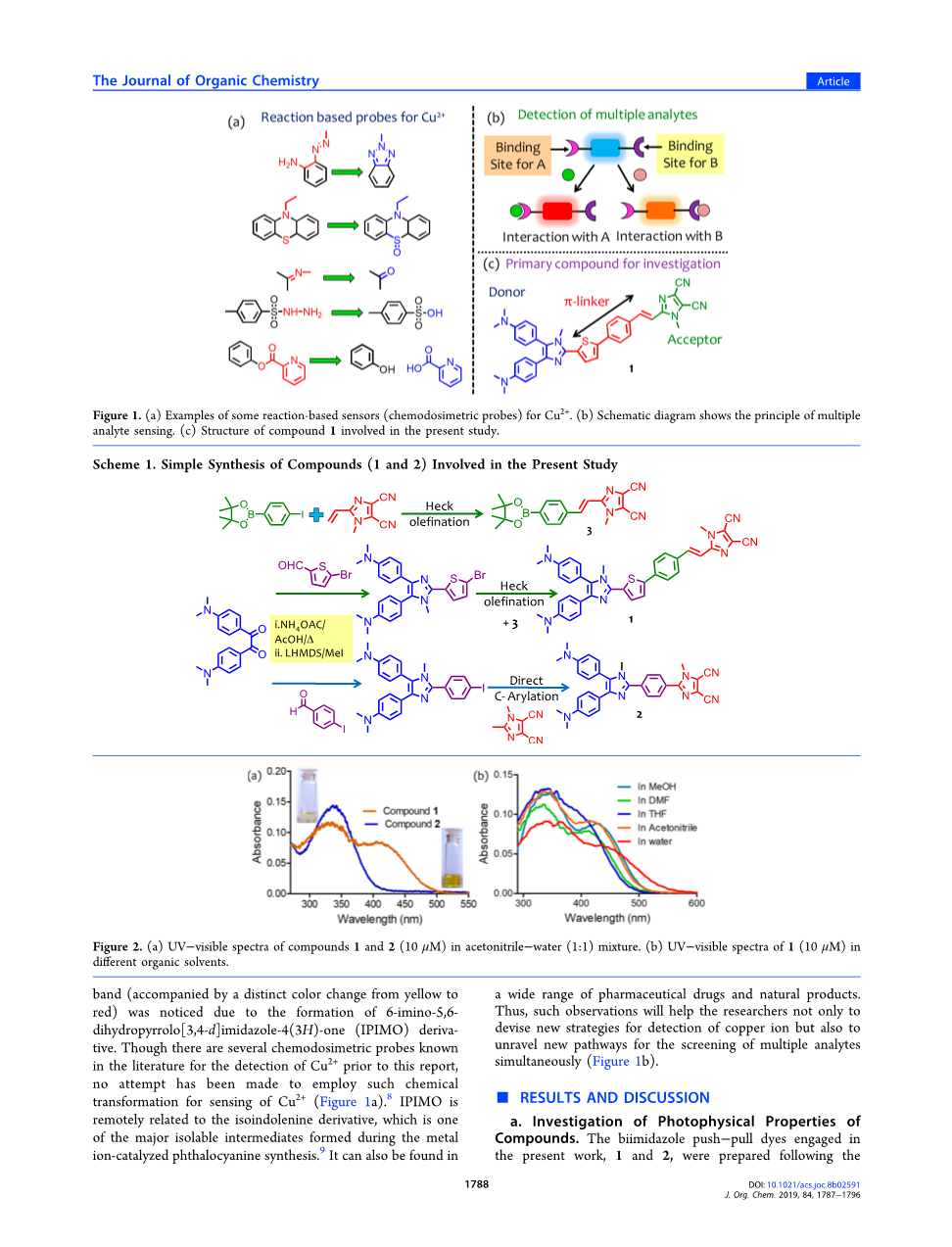
图1.(a)Cu2 的一些基于反应的传感器(血液代谢探针)的实例。(b)示意图显示了多分析物检测的原理。(c)本研究中涉及的化合物1的结构。方案1.本研究中涉及的化合物(1和2)的简单合成
图2.(a)化合物1和2(10mu;M)在乙腈-水(1:1)混合物中的紫外-可见光谱。(b)在不同有机溶剂中的1(10mu;M)的紫外-可见光谱
由于6-亚氨基-5,6-二氢吡咯并[3,4-d]咪唑-4(3H)-酮(IPIMO)衍生物的形成,注意到带(伴随着从黄色到红色的明显颜色变化)。虽然在本报告之前有文献中已知有几种用于检测Cu2 的化学计量探针,但没有尝试采用这种化学转化来检测Cu2 (图1a)8。IPIMO是与异鞘氨醇衍生物遥相关,它是在金属离子催化的酞菁合成过程中形成的主要可分离中间体之一9。它也可以在各种药物和天然产品中找到。因此,这些观察结果不仅有助于研究人员设计出检测铜离子的新策略,而且还可以解开同时筛选多种分析物的新途径(图1b)。
结论和讨论:
图3.(a)在乙腈-水(1:1)混合物培养基中用Hg2 (0-2当量)的化合物1(10mu;M)的UV-可见滴定。(b)在不同金属离子存在下,化合物1(10mu;M)在545nm处的吸光度变化。化合物1(10mu;M)与Cu2 (c)0-1.0当量和(d)在乙腈-水(1:1)混合物介质中的1.0-2.0当量的UV-可见滴定。(在10分钟的孵育时间后记录所有数据点。)金属离子的高氯酸盐用于传感研究。
- 化合物光物理性质的研究。参与本工作化合物1和化合物2的二咪唑推拉染料按照我们在文献中报道的方法制备(方案1和图S25-S26)10。两种分子均利用咪唑环作为电子供体和受体,这取决于它们的4,5-二取代的类型,并且在电子释放和抽取部分之间的pi;-连接体不同。与具有简单1,4-亚苯基pi;-连接基的化合物2相比,化合物1显示出低能量的电荷转移带,缩小的HOMO-LUMO间隙,并且由于存在延伸的,平面的和附着噻吩的pi;而具有更高的极化率。连接基。因此,在半水环境中,化合物1呈现黄色溶液,CT带位于420nm,而对于化合物2,溶液是无色的,没有超过400nm的可检测吸光度(图2a)。化合物1的紫外-可见光谱还显示在274nm(ε=3.50times;104M-1cm-1)和340nm(ε=2.42times;104M-1cm-1)处存在额外的吸收带好。274nm处的谱带可能源自pi;-pi;*跃迁,而n-pi;*跃迁导致340nm波段。最重要的是,发现红移吸收最大值(在415nm处)易受供体或受体电子环境变化的影响。正如预期的那样,由于偶极子诱导偶极子与溶剂分子的相互作用,在极性溶剂中观察到ICT带的红移(图2b和S1)11。因此,在游离探针中,发现HOMO位于N,N-二甲基苯胺基片段上,而LUMO分布在4,5-二氰基-咪唑单元上(图7c)12。最值得注意的是,由于噻吩和苯乙烯部分允许的有效共轭,发现前线分子轨道分布在分子框架的大部分上,而不是集中在特定的单元上。
化合物1的荧光光谱显示出在大波长范围内扩展的宽发射带(图S6)。在光谱的蓝色侧,我们可以观察到370nm处的肩峰。然而,发射分布由三个宽的红移带主导,分别出现在~412,437和484nm处。所有发射波长的激发光谱是相同的。因此,人们可以得出结论,各种发射带,包括具有大的浴-变换的带,仅由于激发态效应(单基态物质)13而出现。这种激发独立的多个发射带的起源可能可以通过其刚性构象来解释。
B.化合物与金属离子的相互作用。当化合物1暴露于宽范围的过渡金属离子时,Cu2 引起溶液颜色从黄色变为红色,而在Hg2 存在下变为无色。具有Hg2 的1的UV-可见光谱显示420nm处的吸光度值降低,伴随340nm处的增加。用Hg2 进行的滴定研究表明吸光度值的“比例”变化与405nm处的等吸光点(图3a和S2)。在滴定研究中存在明确的等吸收点表明分子探针与Hg2 离子之间存在一对一的平衡。相反,用Cu2 (0-1.0当量)滴定导致形成新的在~520nm区域的吸收带。此外,我们可以注意到274和420nm波段的吸光度值减小,340nm处的增强(图3c和S2)。因此,在350,405和472nm区域观察到存在多个等吸光点。然而,超过1.0当量的Cu2 ,吸收光谱发生了急剧变化。发现新的CT带在545nm处形成(从其原始位置红移~30nm)。可以追踪新的等吸光点的外观,位于345和400nm区域(图3d),但这些点没有明确定义。这清楚地表明了Hg2 和Cu2 与探针1之间相互作用模式的差异。尽管在Hg2 存在下吸光度的变化是非常瞬时的,但有必要提供至少2分钟的孵育时间。用Cu2 看到所需的变化(图S3)。浓度变化研究还表明,本系统可以分别检测低至32.8和2.2ppb的Hg2 和Cu2 。由于选择性是比色探针最理想的标准之一,我们研究了除Cu2 和Hg2 以外的金属离子对乙腈-水(1:1)混合介质中1的吸收光谱的影响。从图3b和S4中可以看出,所用的金属离子都没有能够引起1的吸收光谱的显着变化。考虑到时间延迟响应的可能性,化合物1进一步与这些金属离子一起温育用于48小时虽然时间演变曲线表明在某些路易斯酸性金属离子(例如Ca2 ,Mg2 和Zn2 )存在下545nm处的吸光度值增加,但变化程度与此相比足够低。用Cu2 观察。因此,在存在这些金属离子的情况下,1的颜色没有可检测的变化。尽管用Hg2 和Cu2 离子均观察到可见的颜色变化,但发现1(在长UV灯下看到)的青色发射在Cu2 存在下选择性地猝灭(图S6)。尽管发射猝灭(~eightfold),但当在Cu2 存在下记录时间相关的发射光谱1时,没有观察到平均寿命的显着变化(图4a和S7)。即使添加Cu2 ,该化合物也显示出多指数衰变。这些观察结果表明在Cu2 存在下形成非荧光复合物形成(静态猝灭)。
图4.(a)化合物1(10mu;M,lambda;ex=340nm)与Cu2 (0-2当量)的时间依赖性荧光光谱,在442nm处监测。(b)在乙腈-水(1:1)混合物介质中,化合物1与Cu2 的作用图。(c)化合物1(5mM)与Hg2 (0-10mM)在DMSO-d6/D2O(5:1)混合物培养基中的1HNMR滴定。
C.金属离子传感机理:IPIMO的形成。为了深入了解这些机制,使用连续变化法(Jobsplot)确定金属离子与探针之间相互作用的化学计量。我们观察到1和Hg2 离子之间的1:1相互作用,其中x=0.5处的拐点(x=1的摩尔分数)(图S8)。然而,在Cu2 离子存在下,化合物1在x=0.33和x=0.55处显示出两个拐点(图4b)。这意味着Cu2 可以在反应介质中形成两种不同类型的络合物,具有1:1和1:2的化学计量,可能是由于存在两种不同的腈官能团。计算出化合物1与Hg2 离子的结合常数为5.92plusmn;0.01(对数标度)(图S9)。在化合物1和Hg2 的混合物中加入EDTA基本上恢复了442nm处的吸收峰;对于Cu2 没有观察到这种信号反转(图S10)。因此,我们可以得出结论,探针1与Hg2 形成可逆的配位络合物,而其与Cu2 的相互作用本质上是剂量学的.1HNMR2 的1HNMR滴定在DMSO-d6/D2O(5:1)混合物中进行(图4c)。在Hg2 存在下,所有质子信号都被降频。特别是,标记为“a”和“b”的噻吩信号在配位Hg2 离子时经历了巨大的扩展和减少。这些观察结果表明化合物1可能通过噻吩残基配位Hg2 。
相反,由于Cu2 的开壳电子构型(d9系统),用Cu2 的1HNMR滴定显示所有峰的顺磁性猝灭(图S11)。因此,为了检查Cu2 的结合模式,使化合物1和Cu2 在室温下在乙腈-水中反应,得到红色沉淀物,将其收集,彻底洗涤,并进行NMR分析(DMSO-d6/D2O(5:1)(图S12-S13)。产物的1HNMR谱中未追踪化合物1的特征峰,这表明化合物1与Cu2相互作用时形成新物质 。一般情况下,1HNMR信号向下移动,新信号出现在~8.8ppm,这可能归因于enamido质子.1H-和13CNMR谱的另一个显着特征是重复这表明形成了两种IPIMO异构体,尤其是在1HNMR光谱的脂肪族区域中观察到的一组易于区分的新的N-CH3信号(图S13)以及出现的新峰。在13CNMR中为178和150ppm(图S14)。后者的信号是对应的分别对新形成的羰基和酰亚胺碳。然而,通过样品的相对低的溶解度阻碍了适当的13CNMR分析。IPIMO位置异构体I和II(图5a)的形成可以通过水解两个不相等的CN基团来合理化。两种区域异构体在NH和N-CH3基团的取向上不同。我们已经报道了在咪唑啉的N-官能化时类似的区域异构体的形成14。阳性模式的HR-ESI-MS谱证实存在剂量加合物,m/z为652.2734Da(图S15);IPIMO计算的m/z为652.2727Da(Delta;m/z~1ppm)。进一步的光谱证据可以通过FT-IR光谱进行,该光谱没有出现在2231cm-1处的原始1的CN带(图S16-S17)。在1650cm-1处的新峰可归因于烯酰胺单元的羰基,其进一步由明显显着的氢键支持,如3410cm-1处出现的宽带所示。与对Cu2 的反应性相反,在Cu 存在下1没有显示出类似的颜色变化,最可能是由于Cu 和Cu2 离子的不同亲电性(图18)。当对照生物咪唑2与Cu2 相互作用时,类似遇到具有红移CT带的胸部变化(图5b)。这表明腈基团在IPIMO衍生物形成中的重要作用。相反,当用Hg2 处理2时未观察到可检测的变化(图S19),这表明噻吩单元的存在对于识别Hg2 是必需的。此外,为了评估水在Cu2 感测中的决定作用,使化合物1与不同水含量的不同水-乙腈混合物中的Cu2 相互作用。最初,在545nm处观察到吸光度值的增加,同时混合物中水的量增加(lt;50%),表明水在剂量学相互作用中直接参与。在一定百分比(gt;50%)后,观察到吸光度值的突然下降(图5c)。然而,对于Hg2 ,记录了随着水含量升高(0至100%)的光学响应的单调降低(图S20)。这是对Cu2 和Hg2 离子的预期观察,因为由于1的不良溶解性以及金属的高
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[21153],资料为PDF文档或Word文档,PDF文档可免费转换为Word




