钴催化的甲酰芳胺为模块对sp3杂化C-H活化的功能化毕业论文
2020-07-08 21:50:57
摘 要
相对于传统合成方法,碳氢键活化功能化构建新碳杂大大简化了合成工序,并提高了反应原子利用率。由于惰性烷烃的sp3 轨道难与金属轨道相互作用,因此寻找合适的过渡金属催化体系实现惰性烷烃功能化仍具有一定的挑战性。
本论文以不同的甲酰芳胺为胺源,环己烷为反应底物,探索其在廉价过渡金属催化下的胺羰基化反应,取得了以下结果。
首先,以甲酰苯胺为胺源,DTBP为游离基引发剂,对廉价过渡金属催化剂及配体进行筛选,发现了乙酰丙酮镍在无配体情况下具有很好的催化活性。优化后的反应条件为:一氧化碳压力20 bar, 反应温度110 ℃, 环己烷自身作为反应溶剂。从而实现由环己烷一步制备N-苯基环己基甲酰胺(3aa),收率达到92%。
其次,我们以其它几种甲酰芳胺及苯肼酰胺同样实现了镍催化下环己烷、环戊烷的胺羰基化反应,制备了相应的酰胺型产物,收率良好,说明不同取代的甲酰芳胺对该反应具有较好的适应性。
产物均进行了1H-NMR,13C-NMR和HRMS表征。
关键词:sp3碳氢活化 镍催化 胺羰基化反应 环己烷
ABSTRACT
Transition-metal-catalyzed C(sp3)-H activation is the most straightforward route for the construction of C-C and C-heteroatom bonds. In comparation with traditional conversion, activated functionalization of C-H bond can much simplify synthetic steps and efficiently enhance the atomic economy. However, realization of direct functionalization of inert alkanes through transition-metal catalysis remains a challenging issue owning to weak interaction between sp3 C-H bond and metal orbitals.
In this thesis, formanilides were used as amine souce to study trasition-metal-catalyzed aminocarbonylation of cyclohexane.
Firstly, catalyst- and ligand-screening were done with formanilide as amine source initiated by DTBP. Ni(acac)2 was disclosed to be an effective catalyst under 20 bar CO at 110 ℃. By this method, one-step synthesis of N-phenyl cyclohexanecarboxamide (3aa) from cyclohexane was realized with 90% yield.
Secondly, in order to enlarge the scale of the substrate, other different formanilides were examined for this reaction and the products amide were obtained with good yields.
The products were characterized by 1H-NMR, 13C-NMR, and HRMS .
Keywords: sp3 C-H activation, Nickel catalysis, aminocarbonylation, cyclohexane
目录
摘要 I
ABSTRACT II
第一章 文献综述 1
1.1 前言 1
1.2 基于过渡金属催化的碳氢活化反应 2
1.3 基于过渡金属催化的羰基化反应 4
1.4 本课题的意义和主要研究内容 7
第二章 甲酰苯胺为胺源的环己烷胺羰基化 8
2.1 引言 8
2.2 实验部分 8
2.3 实验结果与讨论 11
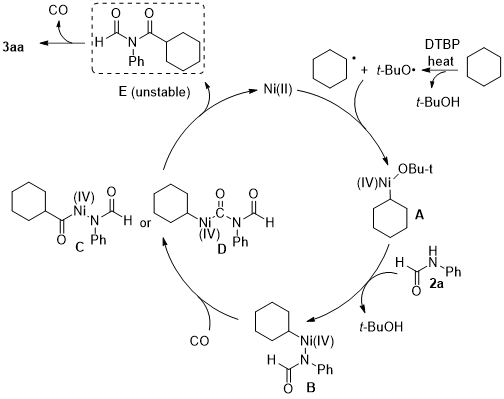
2.4 机理推测 13
2.5 小结 13
第三章 其它甲酰芳胺为胺源的惰性烷烃胺羰基化 14
3.1 引言 14
3.2 实验部分 14
3.3 实验结果与讨论 18
3.4 小结 20
第四章 结论与展望 21
4.1 结论 21
4.2 展望 21
参考文献 22
附录. 25
致谢 51
第一章 文献综述
前言
sp3杂化C-H键选择性活化功能化在有机化学领域中有着很高的研究价值和发展前景。[1]在所有的C-H功能化活化中,过渡金属催化条件下的C-H活化具有较高的选择性。[2]直接从sp3杂化C-H生成目标C-X(X=heteroatom),将是实现有机合成多样化,有机合成步骤简化,高分子的构建与修饰的钥匙。[3]同时,直接将普通的sp3杂化C-H官能团化也符合合成化学中对于原子经济性的要求,但是如何控制sp3杂化C-H活化功能化的选择性导向反应仍是20世纪中期过渡金属在有机化学领域取得成功以来最大的难题之一。[4,5,6,7,8,9,10,11]
相对于sp2杂化的C-H键活化在有机合成的广泛应用,sp3杂化的碳氢键由于其高低能量轨道难与金属轨道碰撞的特殊性,对此的研究较少。[12]但喜人的是,基于sp3杂化的C-H键杂化活化的偶联羰基化反应取得了较大的进步。[13]
过渡金属催化的sp3杂化的碳氢键活化常基于两种机理,分别为内层机理和外层机理。
外层机理指配位金属原子与杂元素成键后杂元素与碳原子和氢原子直接产生相互作用形成中间体或者碳氢键断裂后,杂元素与氢原子发生相互作用形成中间体。两种中间体最后都将脱去配位金属原子并形成碳杂键(图1-1)。[14]在整个sp3杂化碳氢键的活化,并使其功能化的过程中,不生成新的C-M(M=Metal),仅仅发生了碳氢键的断裂。这十分适用于官能团活化的机理。
相关图片展示: