利用CRISR-Cas9基因编辑技术建立抗病毒蛋白PKR基因敲除细胞系毕业论文
2020-02-19 14:35:39
摘 要
CRISPR/Cas9是新兴的第三代靶向核酸酶基因编辑技术,可实现全基因组上的靶向切割。因设计简单、操作方便、成本低,该技术已广泛应用于构建多种动植物和细胞的基因编辑模型。
PKR(eif2ak2)是胞内RNA分子感受器之一,是一种经典的干扰素可诱导蛋白,在抗病毒反应中发挥重要作用。此外,PKR参与多条信号通路的调控,在细胞生长、分化及凋亡等多个细胞生理活动中起作用,并与多种疾病如肿瘤、阿尔茨海默氏症的发生发展有密切关系。
本研究针对PKR基因编码区上游序列设计了2条gRNA,并构建切割载体LentiCRISPR v2-P1、P2,将切割载体用PEI转染法导入Hela细胞内,用G418初步筛选,单克隆挑取培养以及扩大,最后用干扰素刺激后进行western blot检测。结果表明单克隆Hela细胞株中已无PKR蛋白的表达。综上所述,本研究利用CRISPR/Cas9技术成功建立了完全敲除PKR基因的细胞株,为研究PKR的功能和其与相互作用蛋白的关系提供了有效的细胞模型。
关键词:基因敲除;CRISPR/Cas9;PKR
Abstract
CRISPR/Cas9 is an emerging third generation targeted nuclease of gene editing technology , which can achieves genome-wide targeted cutting. Due to its simple design, convenient operation and low cost, this technique has been widely used to construct gene editing models of various plants, animals and cells.
PKR (eif2ak2), one of the receptors of intracellular RNA molecules, is a classical interferon-inducible protein that plays an important role in antiviral response. In addition, PKR is involved in the regulation of multiple signaling pathways, plays a role in cell growth, differentiation, apoptosis and other cellular physiological activities, and is closely related to the occurrence and development of various diseases such as tumors and alzheimer's disease.
In this study, two gRNAs were designed for the upstream sequence of PKR gene coding region, and the cutting vectors LentiCRISPR v2-P1 and P2 were constructed. The cutting vectors were introduced into Hela cells by PEI transfection, and were preliminarily screened by G418, monoclonal culture and expansion. Finally, western blot analysis was performed after interferon stimulation. The results showed that there was no PKR protein expression in the monoclonal Hela cell line.
In conclusion, this study successfully established cell lines with PKR gene knockout by using CRISPR/Cas9 technology, providing an effective cell model for studying the function of PKR and its relationship with interacting proteins.
Key Words: gene knock-out;CRISPR/Cas9;PKR
目 录
第1章 绪论 1
1.1 基因编辑技术 1
1.1.1 ZFN技术 1
1.1.2 TALEN技术 2
1.1.3 CRISPR/Cas9技术 3
1.2 PKR基因的概述 5
1.3 研究目的与意义 7
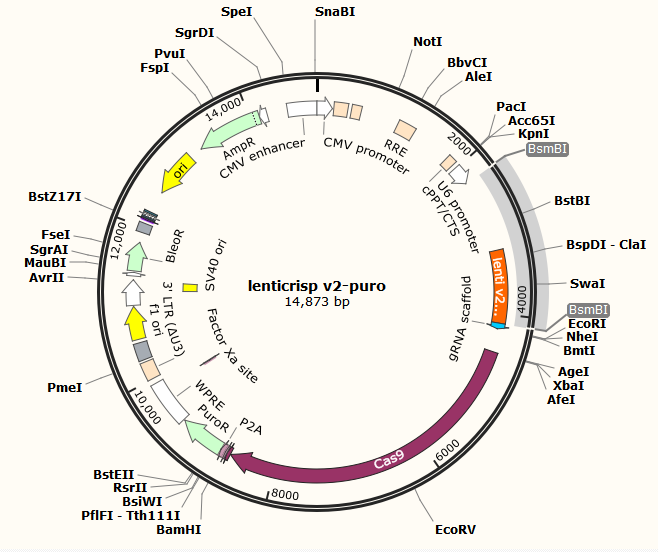
第2章 构建CRISPR切割载体 8
2.1 材料与方法 8
2.1.1 实验材料 8
2.1.2 实验方法 10
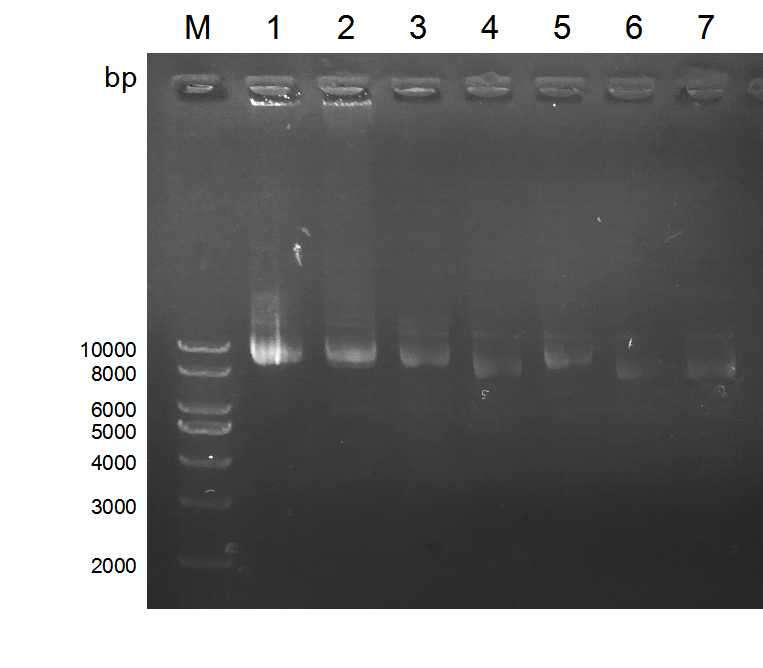
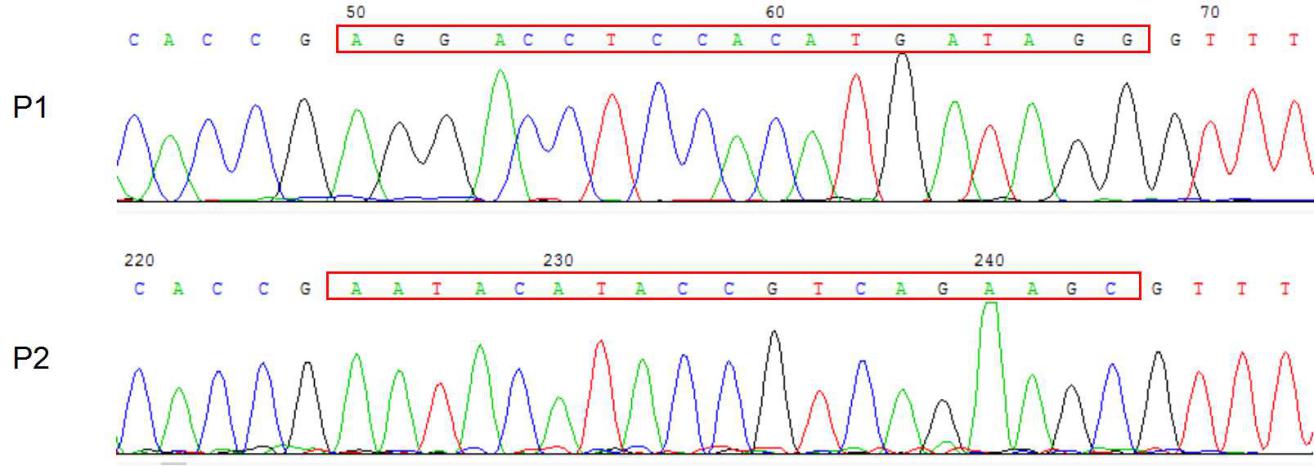
2.2 实验结果 13
2.2.1 gRNA的设计 13
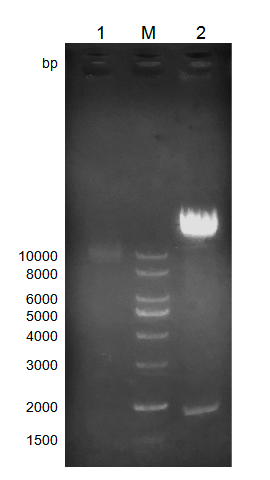
2.2.2 lentiCRISPR v2酶切 14
2.2.3 切割载体的检测 15
2.3 讨论 17
第3章 PKR敲除细胞系的获得 18
3.1 材料与方法 18
3.1.1 实验材料 18
3.1.2 实验方法 20
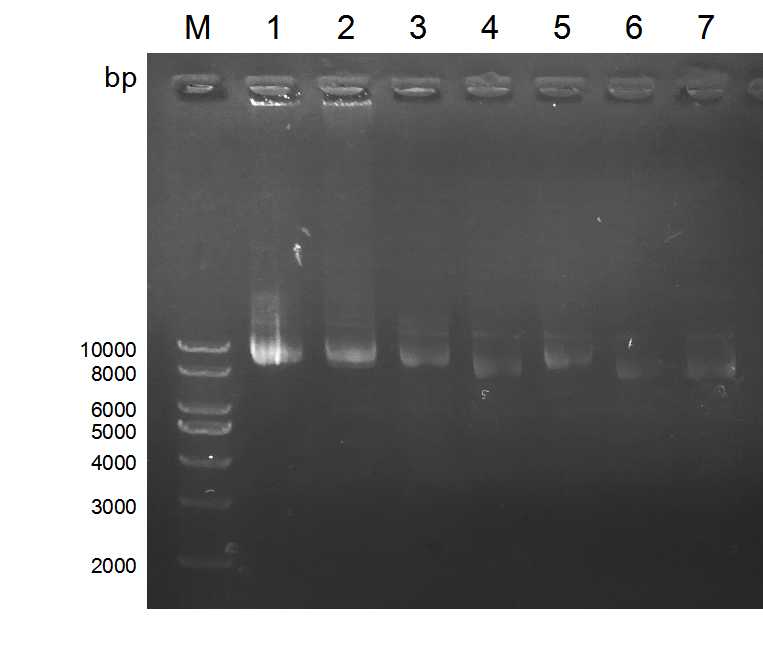
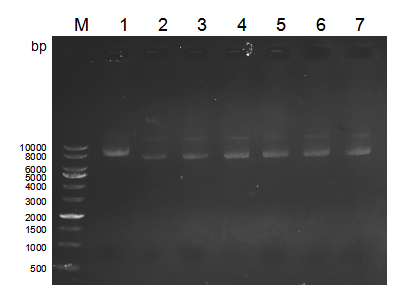
3.2 实验结果 24
3.2.1 G418最小致死剂量 24
3.2.1 lentiCRISPR v2-GFP转染效率 25
3.2.1 Western blot检测单克隆细胞株中PKR蛋白的表达 26
结论 28
参考文献 29
致谢 31
第1章 绪论
1.1基因编辑技术
基因编辑是指对目的基因序列进行靶向修饰,包括目的序列的删除、插入、置换等操作。基因编辑技术是研究基因功能和相互作用的强有力的手段,此外,还可以应用于培育动植物新品种,在遗传疾病的治疗方面也有巨大潜力,如在人类基因治疗的背景下直接纠正有害突变。
然而,真核生物的基因组含有数十亿个DNA碱基,要在其中对目的序列进行靶向操作十分困难。最早在1980s提出的同源重组技术(HR)是基因编辑领域的一个重大突破[1,2],其工作原理是将两端含有靶位点同源序列的外源片段导入细胞,然后利用细胞内在的同源重组机制,使外源片段与靶位点发生整合,从而实现基因的靶向修饰。但通过HR技术达到精确基因编辑的目的需要细胞自然发生同源重组,除某些哺乳动物的胚胎细胞外,其发生的概率极低,106–109个细胞中才有一次目的的同源重组发生[3],这极大的限制了该方法在大多数物种和细胞中的应用。
靶向核酸酶系统在基因编辑领域的应用解决了HR技术基因编辑效率低的问题,由于人工诱导的靶向DNA的双链断裂(DSBs),激活细胞内的DNA修复机制,使高效和精确的基因修饰成为可能。细胞可通过HDR(同源定向修复)或者 NHEJ(非同源末端连接 )两中方式修复DSBs[4],当发生HDR时,细胞以人工导入的同源模板进行准确的无错修复,研究者 ;当发生NHEJ时,缺口处随机发生碱基的插入、缺失或替换,此方式可产生移码突变,形成基因敲除的效果。目前已有三大类基于靶向核酸内切酶的基因编辑系统得到广泛应用,分别是ZFN、TALEN、CRISPR/Cas9技术。下面将对这三种基因编辑技术进行介绍,并从研究历史、发展与应用等方面对CRISPR/Cas9技术进行综述。
1.1.1 ZFN技术
锌指核酸酶(Zinc finger nucleases, ZFN)是第一个广泛应用于基因编辑的靶向核酸内切酶工具,已在多种细胞和动物中实现了靶向基因修饰。ZFN是由锌指蛋白(ZFP)和非特异性核酸内切酶FokⅠ组成的融合蛋白。ZFP具有DNA序列识别的特异性,通常由3-6个锌指(ZF)结构串联组成,锌指是识别核苷酸的单元,约由30个氨基酸构成,其中某些氨基酸残基可与三个连续的核苷酸特异配对[5,6]。ZFN技术的靶向切割原理如图1.1,通过设计合适的ZFN,在目的切割位点的上下游,2个ZFN的ZFP结构域分别与双链DNA中的一条链特异性结合,并且间隔在要求的范围5-7bp时,FokⅠ二聚化而激活,切割靶位点形成DSB[6]。但由于锌指的氨基酸残基与核苷酸的对应关系复杂,且存在上下文依赖效应的约束,该技术无法对任意一段DNA序列设计出有效的ZFN,在目的基因区段可设计的切割位点少,再加上操作繁琐,价格昂贵等缺点,使ZFN的广泛应用受到限制。
图1.1 ZFN原理示意图
(图片引自Thomas Gaj,Trends in Biotechnology,2013)

1.1.2 TALEN技术
转录激活因子样效应物核酸酶(Transcription activator like effector nucleases,TALEN)是在ZFN技术的基础上发展和应用的另一种人工核酸酶,其作用原理与ZFN十分类似,主要区别在于ZFN中的每个锌指单元识别三个核苷酸,而TALEN中的每个串联重复模块识别一个核苷酸。TALEN主要由TALE蛋白结构域与FokⅠ切割结构域构成,TALE蛋白通常由15.5-19.5个串联重复模块组成,每个模块含34个氨基酸,其序列高度保守,除了12th和13th氨基酸,它们被称之为重复可变的双氨基酸残基(RVD),正是RVD可以特异的识别单个核苷酸[6,7]。

图1.2 TALEN原理示意图
(图片引自Thomas Gaj,Trends in Biotechnology,2013)
与ZFN相比,TALEN的TALE蛋白域识别靶DNA序列的规则更简单,几乎在对基因组的任何位置设计靶向切割位点,且特异性更强切割效率更高。但是由于TALEN蛋白分子量较大,以DNA、mRNA、蛋白酶的形式递送该分子进入细胞都存在效率低的问题[8]。且该技术仍然操作复杂、成本高。
1.1.3 CRISPR/Cas9技术
CRISPR/Cas9是新兴的第三代基因编辑技术,与ZFN、TALEN不同,其对目标序列的识别是通过guideRNA与核酸的互补配对,而不是通过蛋白质中重复模块与核酸的相互作用,因此使用者设计起来非常简单。因其操作方便、成本低、效率高等特点,CRISPR/Cas9技术一经出现便成为研究热点,CRISPR全称是Clustered Regularly Interspaced Short Palindromic Repeats(成簇的规律间隔的短回文重复序列),它存在于已测序的40%的细菌和90%的古细菌中[4],是一种抵抗如病毒感染、质粒导入的外来遗传物质入侵的适应性免疫系统。
1.1.3.1 CRISPR/Cas9研究历史
1987年,CRISPR基因序列在日本学者研究大肠杆菌时被首次发现,但功能不明[9]。随着测序技术的发展,这种串联重复序列被发现广泛存在于细菌和古细菌的基因组中。2002年被命名为CRISPR。2005年,研究者发现CRISPR序列中的间隔序列与宿主染色体外噬菌体相关的遗传物质同源,这一重要的发现让人们不由推测CRISPR序列与宿主菌的抵抗微生物的免疫记忆机制有关,并通过实验得到了证实,随后一系列研究阐明了宿主菌中CRISPR系统的防御机制。2010和2011年的两项研究表明,在Ⅱ型CRISPR系统中Cas9、crRNA、tracrRNA三种必要成分能构成靶向核酸内切酶[4],从此,利用Cas9系统进行基因编辑的研究在各地实验室迅速开展。2013年,CRISPR/Cas9系统首次成功应用于真核生物的基因编辑,至今已发展为广受欢迎的新一代基因编辑技术。
1.1.3.2 CRISPR/Cas系统的自然功能
CRISPR簇主要由上游的Cas基因家族和下游的CRISPR序列组成。其中CRISPR序列由多个重复序列(Repeats)和间隔序列(Spacers)串联构成,Repeats短而保守,可形成发夹结构;Spacers来源于被细菌俘获的外来遗传物质,相当于免疫系统的黑名单,当黑名单上的外来核酸再次入侵时,CRISPR序列与Cas蛋白就会联合作用,将其降解。CRISPR序列上游还有一段前导区(Leader),被认为是CRISPR序列的启动子。以病毒感染为例,CRISPR/Cas系统的防御过程可分为外源基因俘获、crRNA合成、靶向干扰三个步骤[10]:
- 外源基因俘获;当病毒的DNA注入细菌内部后,CRISPR系统的Cas1/2蛋白复合物将对其DNA进行扫描,并截取其中一段序列,然后在其它酶的作用下,这个片段被插入前导区与第一个Repeats之间,作为一个新的间隔序列(Spacers)被整合到宿主基因组的CRISPR序列中。病毒基因组中与这段间隔序列对应的片段就被称为原间隔序列(Protospacer),然而Cas1/2蛋白复合物对原间隔序列的截取不是随机的,其一端需要有几个保守碱基,通常为NGG,这被称为原间隔序列临近基序(PAM)。
- crRNA合成:当病毒二次感染时,CRISPR序列在前导区启动子的调控下,转录出pre-crRNA(pre-CRISPR-derived RNA)大分子和tracrRNA(trans-activiting crRNA)小分子,根据入侵者类型,pre-crRNA进一步被Cas蛋白剪切成更小的成熟的crRNA。crRNA,tracrRNA及Cas9组成最终的复合物,发挥干扰作用。
- 靶向干扰:crRNA/tracrRNA/Cas9复合物扫描病毒的基因组,crRNA识别与之互补的原间隔序列并与之结合,引导Cas9蛋白定位于PAM/前间隔序列的区域,切割DNA双链,使外源核酸降解。
1.1.3.3 CRISPR/Cas9技术的发展与应用
CRISPR/Cas系统可分为3个类型,其中Ⅱ型系统成分最为简单,其识别和切割外源靶DNA序列只需要一种Cas蛋白(即Cas9蛋白)[11],因而被深入研究并作为基因编辑工具被广泛应用。2012年,M.Jinek将CRISPR/Cas9系统中的crRNA和tracrRNA整合为单链,并称为guideRNA(gRNA),这使得该系统简化为只有Cas9蛋白和gRNA两种原件[12]。
目前常用的Cas9蛋白来自于酿脓链球菌和嗜热链球菌,其结构如图1.3,它含有RuvC和HNH两个切割域,通过gRNA与靶序列的互补配对,Cas9蛋白被引导到目的位点行驶切割功能,产生双链断裂[4]。

图1.3 CRISPR/Cas9原理示意图(图片引自Patrick D. Hsu,Cell,2014)
较高的脱靶效应一直是限制CRISPR/Cas9技术应用的主要问题,科学家改造出Cas9n蛋白,提供了一种减低脱靶效应的方法[13]。Cas9n蛋白的RuvC和HNH切割结构域其中一个因点突变而失活,只能产生单链缺口,需将两个由相应gRNA引导的Cas9n配对使用才可产生双链断裂,这样gRNA与靶序列结合的特异性大大提高,可将脱靶率降低50-100倍。
目前,CRISPR/Cas9技术已被成功应用于多种模式动物和细胞的基因编辑,构建目的基因的缺失、替换、插入突变体。在全基因组功能基因筛选方面,可用多个gRNA分子对多个基因同时打靶,造成相应基因功能的丧失,进一步筛选找到执行功能或导致疾病的关键基因;在基因治疗方面,该系统也有着潜在应用价值,可尝试通过直接修复基因来治疗人类遗传疾病。除了在基因编辑方面的应用,CRISPR/Cas9系统还有多种其他的功能被发掘,如调控基因的转录、定位活细胞中基因或蛋白的位置[14]。
1.1.3.4 CRISPR/Cas9技术的前景
CRISPR/Cas9技术使研究者能更方便、快速地获得靶向编辑的细胞和动物模型,大大促进了基因编辑技术的广泛应用。但脱靶效应等问题限制了 CRISPR-Cas9 系统在某些领域的应用。对于该系统存在的不足,科学家们也在进行一系列研究,在检测脱靶位点、开发不同CRISPR系统元件、改进递送方式等方面对 CRISPR-Cas9系统优化,使其成为更特异、高效的靶向基因编辑工具。可以预测,未来CRISPR/Cas9技术将在基础研究、生物工程、临床医疗等领域继续发挥重要作用。
1.2 PKR基因的概述
双链 RNA 依赖性蛋白激酶(protein kinase regulated by double-stranded RNA,PKR),是先天免疫反应中一个重要的干扰素可诱导的抗病毒蛋白[15]。干扰素(IFN)是动物细胞分泌的一类多功能活性糖蛋白 ,具有广谱抗病毒、抗肿瘤和调控免疫应答等多种生物学效应。病毒感染细胞后,刺激干扰素大量的合成分泌,但干扰素并不直接发挥抗病毒作用 ,而是通过旁分泌和自分泌与细胞膜上的受体结合,激活STAT/JAK 信号通路,调控下游多个干扰素调控基因的转录和翻译[16,17],包括抗病毒调节物和转录调节因子,从而发挥抗病毒作用。其中抗病毒蛋白PKR是IFN介导的固有免疫应答中发挥作用的主要下游分子之一。

图1.4 PKR蛋白结构(图片引自邓政东,武汉生物工程学院学报,2006)
PKR蛋白共有551个氨基酸,可分为调控区域(1-264aa)和催化区域(265-551aa),如图1.4,调节区域含有两个串联的双链RNA结合基序 (dsRBM),可介导PKR与dsRNA的结合;催化区域的N端(244-296aa)负责PKR的二聚化,C端含有11个保守亚结构域,分别与结合ATP、磷酸化eIF-2α等功能有关[18]。

图1.5 dsRNA介导的PKR活化过程
(图片引自M. A. GarcÍa,Microbiology amp; Molecular Biology Reviews, 2006)
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: