CIB1和CO相互作用介导开花的cry2依赖的调控外文翻译资料
2023-01-04 11:01:12
CIB1和CO相互作用介导开花的cry2依赖的调控
刘亚文,徐丽丽,马定邦,紫如晨,王佳伟,刘璐
摘要
隐花色素是光裂解样光感受器。拟南芥CRY2(隐花色素2)主要介导光周期花启动的调节。 CRY2已被证明可以促进FT(开花位点 T)mRNA表达来响应蓝光通过抑制CO蛋白质的降解(CONSTANS)和激活CIB1(CRY2相互作用的bHLH1)。虽然CIB1和CO都是FT的转录激活因子,它们的关系是未知的。在这里,我们展示了CIB1的物理交互与CO和促进FT转录的CO依赖方式。 CRY2,CIB1和CO形成响应的蛋白质复合物蓝光激活FT转录,复杂的是由光周期和黄昏时的峰值调节更高的FT表达。我们还确定CRY2是通过CIB1和CO招募到FT染色质,这三者都是蛋白质与FT启动子内的相同区域结合。因此,CRY2-CO和CRY2-CIB之间存在串扰途径,CIB1和CO共同作用来调节FT转录和开花。
关键词:CIB 1;CO;隐色素;开花时间;FT
主题范畴:发育分化;植物生物学;转录
介绍
隐色素(CRY)是与光解酶相关的蓝光受体在植物和动物中介导光响应.光激发CRY经历了几次生物物理和生化变化,包括环状电子转移,磷酸化,泛素化,和构象变化,以改变基因和蛋白质的表达转录水平和翻译后水平[4,5]。该拟南芥基因组编码至少两种隐花色素,即密码染色体1(CRY1)和CRY2。 CRY1的主要功能是介导蓝光依赖的去黄化反应,而拟南芥CRY2的主要作用是光周期调节花开始。
CO(Constans)和FT(开花位点T)是光和时间信号整合对光周期反应的重要调控因子之一。CO是一种转录调节因子,通过激活FT促进开花mRNA表达。FT是一种RAF激酶抑制蛋白,它通过从叶子迁移而充当长距离信号通过血管系统到顶端分生组织。FTmRNA的含量在开花时间中起着非常重要的作用。响应长日(LD)条件的FT转录激活是拟南芥开花光周期诱导的限制步骤。
已经显示CRY2通过抑制CO蛋白的降解和通过直接激活CIB1(CRY2-互作用bHLH1)转录因子来激活响应于蓝光的FT mRNA表达。CRY2稳定CO蛋白的能力可部分解释为CRY2-COP1(组成型光致形成1)-SPA1(PHYA-105抑制剂)复合物的轻微独立形成。 COP1是E3泛素连接酶,其靶向CO和几种其他转录因子用于降解,并且光引用CRY2与SPA1相互作用以抑制CO1的COP1依赖性降解。CIB 1是第一个被描述的蓝光依赖性CRY 2相互作用蛋白。它促进CRY依赖的开花
通过激活FT的转录的方式。CIB1(CIB2,CIB4和CIB5)与CIB1冗余地起作用以通过形成不同的异二聚体来激活FT转录。 所有这些同源物均正调节CRY2介导的光周期开花和FT转录。
虽然CIB 1和CO都是FT的转录激活因子,但它们之间的关系尚不清楚。在这里,我们证明CIB 1和CRY 2以CO依赖的方式促进FT转录和开花, CO可以独立于CIB。CIB 1和CO相互作用,共同诱导FT转录。在蓝光作用下,Cry2、CIB 1和CO形成一个蛋白质复合物。此外,CRY 2是 cbb 1和co被引入FT启动子,它们都结合在同一染色质区,因此cry 2-co和cry 2-cibs通路相互作用,调节FT转录和开花。
结果与讨论
cbb 1以CO依赖的方式促进FT转录和开花。
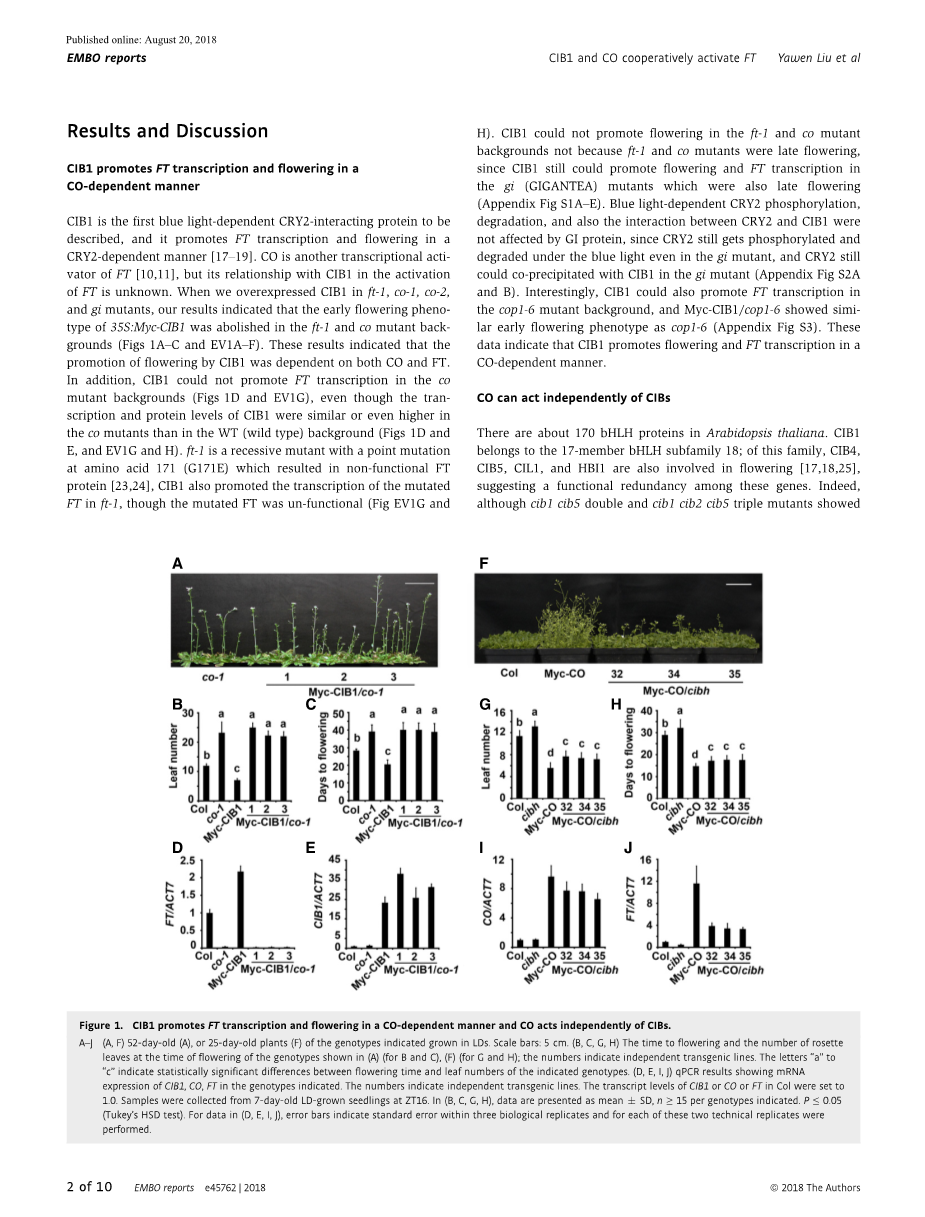
CIB 1是第一个被描述为蓝光依赖性的CRY 2相互作用蛋白,它以CRY 2依赖的方式促进FT的转录和开花。CO是另一种转录FT的活性催化剂,但它与CIB 1在FT激活中的关系尚不清楚。当我们在ft-1,co-1,co-2和gi突变体中过表达CIB1时,我们的结果表明,在ft-1和co突变体背部基因中,35S:Myc-CIB1的早期开花表型被废除了(图1A-C和EV1A-F)。这些结果表明,CIB 1对开花的促进作用既依赖于CO,也依赖于FT。此外,CIB1不能促进该公司的FT转录突变体背景(图1D和EV1G),即使CIB1的转录和蛋白质水平在共突变体中比在WT(野生型)背景中相似或甚至更高(图1D和E,EV1G和H)。FT-1是一个隐性突变体,突变位点位于171氨基酸(G171E),导致FT蛋白无功能[23,24], CIB 1也促进了FT在ft-1中的转录,尽管突变的FT是非功能的(图EV1G和H)。 CIB1不能促进ft-1和co突变体的开花背景不是因为ft-1和co突变体是晚开花,因为CIB1仍然可以促进开花和FT转录gi(GIGANTEA)突变体也是晚开花的(附录图S1a-E)。蓝光依赖性CRY2磷酸化,降解,以及CRY2和CIB1之间的相互作用不受GI蛋白影响,因为CRY2仍然被磷酸化和即使在gi突变体中也在蓝光下降解,而CRY2仍然存在可以与gi突变体中的CIB1共沉淀(附录图S2A和B)。有趣的是,CIB 1也能促进cop1-6突变背景中FT的转录, Myc-CIB 1/cop1-6表现出与cop1-6相似的早花期表型(附录图S3)。这些数据表明,CIB 1以CO依赖的方式促进开花和FT转录。
CO可以独立于cbs工作
拟南芥中约有170种bHLH蛋白。CIB1属于17名成员的bHLH亚家族18;这个家庭,CIB4,CIB5,CIL1和HBI1也参与开花,表明这些基因之间的功能冗余。事实上,虽然cib1 cib5 double和cib1 cib2 cib5三重突变体在光周期诱导条件下显示出显着的开花延迟,但在LD(长日)条件下没有,表达CIB1的显性阻遏转化的转基因系(CIB1) -EAR)在LD下显示出非常晚的开花表型(附录图S4)。当CIB1-EAR在共同突变体背景中表达时,它始终表现出晚开花表型并且与共单突变体相似地降低FT表达(附录图S4)。我们使用CRISPR / Cas9系统产生cib4c突变体[26],然后制备cib1 cib3 cib5 bee1 bee3 cib4c hextuple(cibh)突变体(图EV2A和B)。 cibh突变体在LD条件下显示出显着的晚开花,尽管不如cry2突变体晚(图EV2C),而cibh突变体中FT的表达低于WT植物(图EV2F)。有趣的是,cibh突变体在35S:Myc CO植物中部分抑制早期开花表型和FT表达升高,尽管cibh和WT植物中CO的转录和蛋白质水平相似(图1F和EV2G)。 gi突变体不能抑制早期开花表型和35S中的FT表达升高:Myc-CO植物虽然是gi突变体表现出比cibh更严重的晚开花表型(附录图S1F-J),在我们的条件下,CO的表达模式不受GI的影响(附录图S2C),表明CO可以独立于CIB起作用,并且CIB可以调节CO活性。总之,这些结果表明CO可以独立于CIB起作用,而cibh可以减弱FT转录激活中的CO活性。
图1. CIB1以CO依赖性方式促进FT转录和开花,CO独立于CIB起作用。
A-J (A,F)52天龄(A)或25天龄的植物(F)表示在LD中生长的基因型。比例尺:5厘米。 (B,C,G,H)(A)(B和C),(F)(G和H)所示基因型开花时的开花时间和莲座叶数;数字表示独立的转基因品系。字母“表示”所示基因型的开花时间和叶数之间的统计学显着差异。 (D,E,I,J)qPCR结果显示所示基因型中CIB1,CO,FT的mRNA表达。数字表示独立的转基因品系。 Col中CIB1或CO或FT的转录水平设定为1.0。在ZT16从7日龄LD生长的幼苗收集样品。在(B,C,G,H)中,数据表示为平均值SD,每个基因型nle;15。 Ple;0.05(Tukey-HSD测试)。对于(D,E,I,J)中的数据,误差条表示三个生物学重复中的标准误差,并且对于这两个技术重复中的每一个进行。
CIB 1与CO共同表达
CIB 1以CO依赖的方式促进开花和FT的转录,CO可以独立于CIB。为了找出潜在的机制,我们首先检查它们是否影响对方的表达。我们的定量PCR结果表明,wt中cb 1的转录与co-1突变体的转录相似,wt和cb 1穗转基因株系中CO的转录也是相似的(图EV3A和B)。CIB 1和CO不影响彼此的转录。此外,使用在相似表达水平的不同互逆突变体背景中过表达CO和CIB1的转基因品系,我们发现CIB1和CO不会影响彼此的蛋白质稳定性WT,cibh和Myc-CIB1过表达株系中的CO的蛋白质水平或WT和co-1突变体中的CIB1是相似的(图2A-D和EV3C)。有趣的是,CIB1和CO都被发现受光周期调节并且共表达; 它们的蛋白质在早晨很早就达到了丰富的峰值,并且在具有FT表达的LD中在黄昏时再次达到峰值
(图2A-D)。
图2. CIB1和CO是共表达的。
A,B 免疫印迹显示在LD和LD下20小时内WT和co-1背景(A)或WT和cibh背景(B)中的CIB1(A)和CO(B)蛋白水平。 样品在10%SDS-PAGE上分离,印迹,用抗Myc抗体探测,剥离并用抗肌动蛋白抗体(ACT)重新探测。
C,D 如上所述计算在LD和20s期间WT和co-1背景(A)或WT和cibh背景(B)中CIB1(A)和CO蛋白(B)的相对水平(参见材料和方法)。误差条代表Western印迹的三个生物学重复的标准偏差。
图3. CIB1和CO直接交互。
A 荧光显微镜图像显示CIB1与核斑点中的CO共定位。 比例尺:2 lm。
B BiFC测定显示体内蛋白质相互作用。 将本塞姆氏烟草叶的表皮细胞与cCFP-CO和nYFP-CIB1,cCFP-CO和nYFP,或与cCFP和nYFP-CIB1共转化。 BF,明场。 合并,覆盖YFP和明场图像。 比例尺:50 lm。
C 分裂-LUC测定显示CIB1与CO相互作用。本塞姆氏烟草的叶表皮细胞与CO-nLUC和cLUC-CIB1或cLUC或nLUC与cLUC-CIB或cLUC共转化。
D 从10日龄35S:Myc-CIB1,35S:CO-Flag或35S:Myc-CIB1 / 35S:在LD中生长的CO-Flag幼苗制备的样品的Co-IP测定。
E 显示了该工作中使用的CO的示意图。 CO包含两个B-Box域和一个CCT域。
F 体外下拉分析显示CIBC和CO,或CIBC和CODN之间的相互作用以及CIB1C和CODC之间缺乏相互作用。 将His-TF标记的CO,CODN,CODC或His-TF标记的UVR8与从大肠杆菌中纯化的GST-CIB1C混合,并将His抗体用于体外下拉测定。 通过用抗CIB1C抗体或抗His抗体(UVR8,CO,CODC,CODN)探测的免疫印迹分析产物。
数据信息:对于每个实验,进行两次或更多次生物学重复
CIB 1与CO直接相互作用
因为CIB1在FT转录的诱导中依赖于CO和CIB1和CO共表达,我们检查了相互作用CO和CIB1之间。 CO和CIB1共同定位于细胞核中(图3A); 因此,我们使用双分子荧光互补(BiFC)测定检查了它们在植物细胞中的相互作用。在用cCFP-CO和nYFP-CIB1共转化的细胞核中检测到强荧光,但没有荧光在用cCFP-CO或cCFP-CO分别转化的细胞中检测到nYFP-CIB1(图3B)。双分子发光互补(BiLC)测定证实CO直接与CIB1相互作用(图3C)。接下来,我们使用co-IP研究了CO-CIB1相互作用;我们的结果表明CO与CIB1共免疫沉淀(图3D)。此外,体外下拉试验表明CO的C末端与CIB1的C末端相互作用(图3E和F,以及EV3D和E,以及附录图S5),而CRY2与CIB1的N末端相互作用[17]。 co-2是隐性的在B-BOX上在氨基酸59(R59H)处具有点突变的突变体CO蛋白的结构域。与CCT域相互作用一致对于CIB1的C末端,体外下拉分析显示CO-2突变蛋白仍然可以与CIB1相互作用(图EV3D)。之前已经证明CO和CIB1与相似的区域结合在FT推动者。调查是否CO-CIB1可以在植物中检测到相互作用,因为它们都是结合的对FT推动者和DNA将它们拉在一起,我们做了一个共同的IP用DNase处理实验。我们的结果表明即使在DNA酶处理后CO CO也与CIB1一起沉淀,并且它们彼此相互作用而没有FT启动子(图EV3F)。 除CIB1外,CIB5通过BiFC测定显示与CO相互作用(图EV3G),表明多个CIB与CO相互作用。
图4. CO和CIB1促进开花和FT转录在一起。
A 28天龄的基因型植物表明在LD中生长。 比例尺:5厘米。
B,C (A)中所示的基因型开花时的开花时间和莲座叶数。 字母“a”至“c”表示所示基因型的开花时间和叶数之间的统计学显着差异。
D
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 28 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[278830],资料为PDF文档或Word文档,PDF文档可免费转换为Word




