分离DNA用磁性微珠的应用研究毕业论文
2020-04-10 14:46:37
摘 要
目的:沿袭本实验室思路,对本实验室原有新型磁性微珠的制备方法进行改进,利用新制备的磁性微珠进行实际样品中DNA的提取与分离,并探究DNA提取分离过程中的影响因素。
方法:
1磁珠制备及改性:沿袭本实验室思路,使用共沉淀法制备磁珠,但取消通氮气步骤;加入Fe3 离子,进行磁珠的煮沸改性。
2样品处理方法探究:实验用TritonX-100裂解法和SDS裂解法两种方式裂解细菌。
3磁珠提取DNA辅助试剂研究:分别以水、异丙醇、聚乙二醇为辅助试剂提取DNA。
4磁珠提取DNA其他条件(温度、磁珠用量等)研究。
结果:
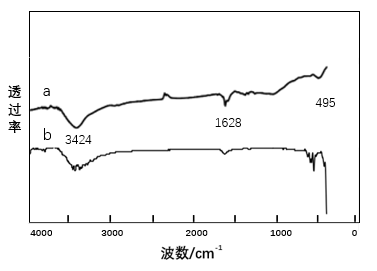
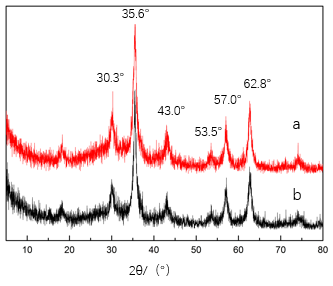
1磁珠制备及改性:制备得到三价铁改性磁珠,经TEM,磁响应初试、FTIR、XRD测试结果表明,制备得到的磁珠粒径为10nm左右,有团聚现象,与未简化制备方法的磁珠结果一致,符合要求。
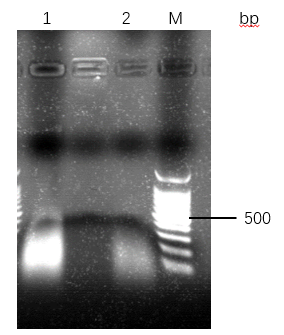
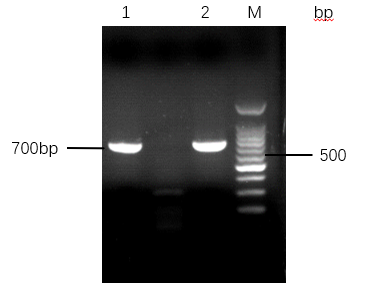
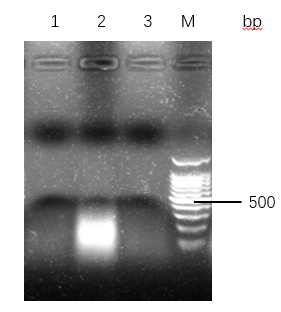
2样本处理方法:探究TritonX-100裂解法和SDS裂解法两种细菌裂解方式,纯度上,TritonX-100法提取的到的DNA A260/A280值在1.8-2.0之间,纯度较高,好于SDS法,A260/A280值大于2.0;产量上,SDS法比TritonX-100法提取的DNA多30ug左右,两者均可以进行下游PCR。
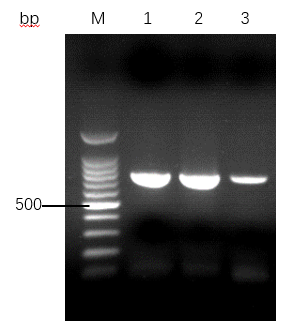
3磁珠提取DNA辅助试剂研究:以异丙醇为结合液提取得到的DNA无论从纯度,产量还是下游PCR上,均明显好于水和聚乙二醇为结合液。
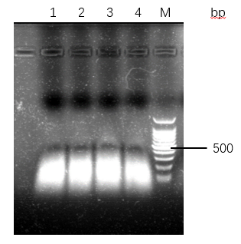
4磁珠提取DNA其他条件(温度、磁珠用量等)研究:随温度,磁珠用量的增加,纯度上A260/A280会有略有增大,当温度大于40℃,磁珠用量大于3mg时,A260/A280的值会大于2,产量上,得到的DNA产量会逐渐增加。
结论:
1磁珠制备及改性:简化磁珠制备方法,使得磁珠的制备更简单,成本更低廉。
2样本处理方法:使用TritonX-100裂解法与SDS法相比,纯度高,产量低。
3磁珠提取DNA辅助试剂研究:三种结合液:水、异丙醇、聚乙二醇,使用异丙醇为结合液最佳。
4磁珠提取DNA其他条件(温度、磁珠用量等)研究:在温度为40℃,磁珠用量为3mg时 最佳。
关键词:三价铁改性磁珠;DNA提取;细菌裂解;DNA提取辅助试剂
Abstract
Objective:Using novel magnetic microbeads for the extraction and separation of DNA in actual samples. The novel magnetic microbeads were prepared according method in our laboratory with a little improvement. The factors influencing effect of DNA extraction and separation were explored.
Methods:
1 Preparation and modification of magnetic beads: Following the idea of our laboratory, the magnetic beads were prepared by co-precipitation method, but the nitrogen gas step was canceled. Then the magnetic beads were modified by adding Fe3 ions and boiling the magnetic beads.
2 Study on sample processing : TritonX-100 and SDS were used to lyse bacteria to compare with each other.
3 Study on auxiliary reagents in DNA extraction with the magnetic beads: DNA was extracted with water, isopropyl alcohol or polyethylene glycol as auxiliary reagents.
4 Study on other factors relating the effect of DNA extraction with the magnetic beads, such as temperature, amout of magnetic beads used.
Result:
1 Preparation and modification of magnetic beads:The prepared magnetic beads satisfied requirements for DNA extraction with the improved method, with a particle size of about 10 nm, agglomerated a little, characterized by TEM, magnetic response initial test, FTIR, XRD.
2 Study on sample processing: Explore the TritonX-100 lysing method and SDS lysis method. In terms of purity, the A260/A280 value of DNA extracted by Triton X-100 method was between 1.8 and 2.0. It was higher than that of the SDS method,which the value of A260/A280 was greater than 2.0. In terms of yield, the DNA extracted by the SDS method was about 30ug more than the TritonX-100 method. Both can perform downstream PCR.
3 Study on auxiliary reagents in DNA extraction with the magnetic beads: Using isopropyl alcohol as the binding solution to extract DNA was significantly better than water and polyethylene glycol in terms of purity, yield, and downstream PCR.
4 Study on other factors relating the effect of DNA extraction with the magnetic beads, such as temperature, amout of magnetic beads used:With the increase of temperature and the amount of magnetic beads, the purity of A260/A280 increased slightly. When the temperature was greater than 40°C and the amount of magnetic beads was more than 3mg, the value of A260/A280 was greater than 2 and the yield of DNA gradually increased.
Conclusion:
1 Preparation and modification of magnetic beads:Simplified magnetic beads preparation method makes magnetic beads easier to prepare and lower in cost.
2 Study on sample processing :Using TritonX-100 lysis method to extract DNA has higher purity and lower yield than SDS lysis method.
3 Study on auxiliary reagents in DNA extraction with the magnetic beads: Among the three binding solutions: water, isopropanol, and polyethylene glycol, isopropyl alcohol is the best binding solution for combination.
4 Study on other factors relating the effect of DNA extraction with the magnetic beads, such as temperature, amout of magnetic beads used: It is best when the temperature is 40°C and the amount of magnetic beads is 3 mg.
Key words: Iron ion modified magnetic beads; DNA extraction;bacterial lysis;DNA extraction auxiliary reagent
目录
第1章文献综述 1
1.1 Fe3O4磁性纳米粒子的制备和修饰 1
1.1.1 Fe3O4磁性纳米粒子的制备 1
1.1.2 Fe3O4磁性纳米粒子表面修饰 2
1.2 磁性纳米粒子在生物磁分离技术上的应用 3
1.2.1 细胞分离 3
1.2.2 蛋白质分离 3
1.2.3 酶分离 3
1.3 磁性微珠用于核酸的提取分离 4
1.3.1 传统的DNA分离方法 4
1.3.2 DNA的固相提取法 4
1.3.3 磁珠法分离DNA 5
1.4 本论文的研究内容和意义 8
1.4.1 本论文的研究内容 8
1.4.2 本论文的研究意义 8
第2章实验部分 9
2.1 试剂、材料、仪器 9
2.1.1 试剂 9
2.1.2 材料 10
2.1.3 仪器 10
2.2 溶液配制 10
2.3 实验方法 11
2.3.1 Fe3O4磁性纳米粒子的制备及修饰 11
2.3.2 制备小牛胸腺基因组DNA标准品 11
2.3.3 磁性纳米粒子的表征 11
2.3.4 培养大肠杆菌 12
2.3.5 细菌DNA的提取 12
2.3.6 细菌DNA的提取结果检测 13
第3章结果与讨论 14
3.1 改性后磁珠的表征 14
3.1.1 TEM检测结果 14
3.1.2 改性后磁珠的外观及磁响应初试 14
3.1.3 红外光谱(FTIR)检测结果及分析 14
3.1.4 X射线(XRD)检测结果及分析 15
3.2 磁珠提取DNA结果检测 16
3.2.1 不同的细菌裂解方式提取的DNA检测 16
3.2.2 不同的结合液提取的DNA检测 18
3.2.3 不同的结合温度提取的DNA检测 20
3.2.4 不同的磁珠用量提取的DNA检测 22
第4章结论与展望 25
4.1 结论 25
4.1.1 磁珠的制备、改性及表征 25
4.1.2 样本DNA(细菌DNA)的提取 25
4.2展望 26
参考文献 27
致 谢 31
第1章文献综述
样品DNA获取是现代生命科学研究与应用中必要和非常常见的基本技术要求,也是临床疾病检测、遗传配型等等应用的要求,因此高效分离、获取高产量、高纯度、高完整度DNA的方法不断得到改进。在已有的方法中,有些方法步骤繁琐,耗时长,对于临床快速检测以及其他应用及研究很不利,已经发展起来的磁珠分离DNA方法是比较理想的方法,为更好的阐述本课题涉及的研究,从几个方面综述如下:
1.1 Fe3O4磁性纳米粒子的制备和修饰
1.1.1 Fe3O4磁性纳米粒子的制备
磁性纳米Fe3O4制备方法包括物理法、微生物法和化学法.其中,物理法和微生物法制备Fe3O4磁性纳米材料对设备的高要求和操作过程的繁琐限制了其应用,目前磁性Fe3O4纳米粒子的制备主要依赖于化学方法,大致包括: 溶胶-凝胶法、化学共沉淀法、高温分解法、微乳液法、水热法、流体注射法、电化学法和超临界流体法。本文简要介绍较常见的几种化学方法。
1.1.1.1溶胶-凝胶法
溶胶-凝胶法又称化学溶液沉积法。在制备过程中,金属前体悬浮在多元醇溶液中,在加热搅拌下形成纳米粒子( NP) ,并缓慢变成溶解状态,形成中间体,然后分解形成金属晶核,进而生长为NP,NP表面原位包覆着具有亲水性的醇配体,使纳米粒子很容易地分散到水介质及其他极性溶剂中。在合成过程中表面活性剂的加入可以适当控制晶体的成核和生长,改变NP的表面形貌和表面电荷。溶胶-凝胶法采用金属醇盐作为原料,成本偏高,且凝胶化过程慢,合成周期长,还需高温煅烧,合成的粒径在亚微米尺度[1]。张新伟等人将溶胶凝胶法与自燃烧法两种制备材料的方法结合起来制备Fe3O4磁性材料,实现了两种方法优势的结合,节约了能源,对于大规模的生产应用具有重要意义[2]。
1.1.1.2化学共沉淀法
水溶液中的化学共沉淀法是最简单有效的化学合成Fe3O4磁性纳米粒子的途径。该方法以NH3·H2O或NaOH 为沉淀剂,加入到一定计量比的Fe3 和Fe2 金属盐溶液中,高速搅拌进行沉淀反应,析出不溶性的氢氧化物和水合氧化物,洗涤并脱水得到所需的磁性纳米粒子。其反应式是:
Fe2 2Fe3 8OH-→Fe3O4 4H2O
利用该方法制备Fe3O4磁性纳米粒子的过程中,离子浓度、pH 值、盐的种类( 如高氯酸盐、氯化物、硫酸盐和硝酸盐等) 、温度、碱的特性和浓度、表面活性剂等对合成的Fe3O4
磁性粒子的大小、磁响应性和表面特性都有影响[3-4]。 共沉淀法合成的纳米粒子粒径小,表面能高,易团聚,难以达到单分散状态,需进行表面修饰提高纳米粒子的分散性。天津大学刘涉江等人采用新型的改进型共沉淀法通过对酸洗废液的氧化,不经过惰性气体保护,制备出性能相当的四氧化三铁磁粉,比饱和磁强度可达85.951emu·g-1,比表面积可达78.116 m2·g-1 [5]。
1.1.1.3高温分解法
高温分解法是通过在高沸点溶剂中加热分解有机金属化合物来制备纳米粒子的方法。涂志江等采用高温热分解无毒的乙酰丙酮铁( Fe( ACAC)3) ,以聚乙二醇、聚乙烯吡咯烷酮为修饰剂,制备了水溶液中分散性好的磁性Fe3O4纳米粒子。高温分解法制得的纳米颗粒结晶度高、粒径分布较窄,粒径大小可控[6]。
1.1.1.4微乳液法
微乳液法利用两种互补相溶的溶剂,在表面活性剂的作用下形成均匀的微乳液,使纳米颗粒的成核、生长等过程局限在一个微小的液滴内,在形成纳米颗粒的同时避免了颗粒之间的进一步团聚。微乳液法制备Fe3O4磁性纳米粒子的过程中,表面活性剂种类和用量和两种互补溶剂的种类和组成等对合成的Fe3O4磁性粒子的尺寸和形貌都有影响。Okoli 等采用微乳液法制备了超顺磁性和粒径范围在2~10 nm 的磁性Fe3O4纳米粒子[7]。微乳液法一次合成制备的纳米粒子产量低,粒子的分离纯化过程复杂,且水溶性差。
1.1.1.5水热合成法
水热合成法是指在密闭体系中,以水为溶剂,在高温( 高于200 ℃ ) 和高压( 高于137.9MPa) 下制备Fe3O4纳米粒子的方法[8]。通过优化水热合成法的实验条件,如反应温度和时间、反应物的浓度和化学计量比、溶剂特性和加入晶种剂等,可以控制纳米粒子的尺寸和形貌。Hou 等以( CH2)6N4和FeCl3为原料,在高压釜内进行水热反应,制备出立方状的氧化铁颗粒[9]。在水热反应中,粉体经历了溶解-结晶的过程,制得的纳米晶体发育较为完整,分布范围宽,粒径小,团聚程度低,且不需要高温煅烧与处理。但由于反应在较高温度和压力下进行,所以对设备的要求较高。
1.1.2 Fe3O4磁性纳米粒子表面修饰
Fe3O4磁性纳米粒子由于比表面能高易发生团聚,导致粒子尺寸不均匀; 且裸露的Fe3O4易被氧化,磁性能降低。通过对粒子表面进行包裹或修饰能避免Fe3O4的氧化并保持磁性能、提高胶体和粒子的稳定性和增加其水分散性,还能调节并丰富粒子各种性能,对粒子进行功能化,获得多功能磁性纳米粒子,拓宽其应用范围。
Fe3O4磁性纳米粒子表面修饰按修饰材料的种类不同可分为三类: 无机材料修饰,主要包括活性炭、碳纳米管、石墨烯、硅胶、金属氧化物等无机材料,通过物理或化学方法与Fe3O4磁性纳米粒子结合; 有机功能分子修饰,通过特异性化学反应如偶联、络合、酯化或酰化反应等与纳米粒子链接的有机功能分子; 高分子聚合物修饰,包括天然高分子聚合物如壳聚糖、明胶、纤维素、淀粉和蛋白等,人工合成高分子聚合物修饰,如聚苯乙烯、聚丙烯酸、聚酰胺类、聚苯胺等.这些修饰过的磁性纳米复合材料,应用广泛,在分离[10-11]、催化[12-13]、电子、环境污染物处理[13=15]和生物医药(如癌症肿瘤治疗[16])等领域[17-18]均发挥着重要作用。
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: