酸性磷酸酯酶的聚乙烯醇固定化及相应酶活影响的研究毕业论文
2020-04-16 16:44:04
摘 要
酸性磷酸酯酶(Acid Phosphatase,AP,EC3.1.3.2)是一种非特异性磷酸酯酶,能够在酸性条件下水解磷酸单酯键。在植物低磷胁迫或是极度干旱时,AP可水解底物磷酸基团供植物吸收利用[1]。目前已有利用该酶催化原理开发成生物传感装置,用于检测某些农药残留、重金属残留等[2]。医学上血清酸性磷酸酯酶还可应用于前列腺癌、原发性肿瘤、恶性肿瘤骨转移等检测。
本研究采用了酶的提取与纯化技术、高分子材料制备以及静电纺丝技术,实现目标酸性磷酸酯酶的固定化,以便后续的连续反应和产品开发。本论文研究目的是为了实现在尽可能减少酶活损失的情况下,使固定化酶的温度稳定性和酸碱稳定性达到提升,从而建立该酶系固定化技术的方法学,为后续多种载体材料固定化效果的测试以及相关产品的研发提供真实、可靠的实验数据。
本实验研究内容包括:(1)重组菌株(B. subtilis WB800/pMA5-Acp)培养、破碎和酶纯化;(2)酸性磷酸酯酶基础酶学性质研究;(3)含ACP的PVP纳米纤维膜的制备;(4)固定化酶的酶学性质研究与对比。
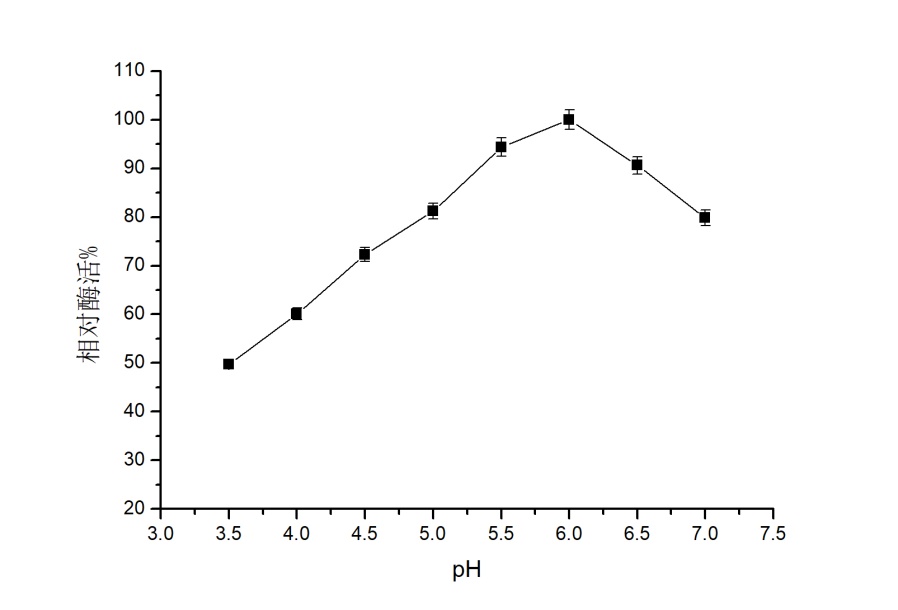
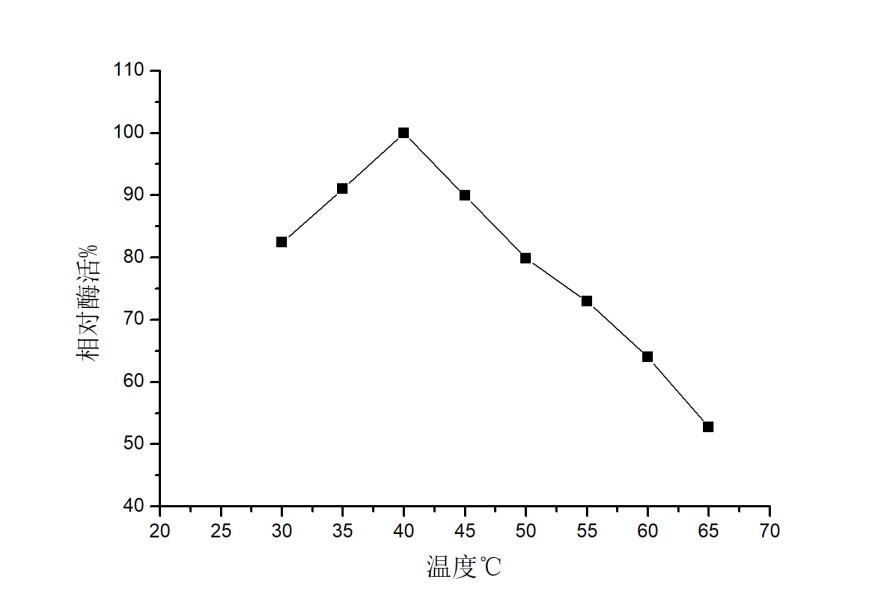
ACP经过Ni柱成功纯化,在SDS-PAGE电泳后,显示出纯的单条带,分子量约为26 kDa。纯化后的酶活37.96 U/ml,比活力(1 mg蛋白质所具有的酶活力单位数)为128.24 U/mg,纯化倍数达19.57倍。该酶的最适反应pH为6.0, pH 5.5-6时,酶活基本保持稳定。该酶最适反应温度为40 ℃,30-45 ℃时,酶的性质较稳定。
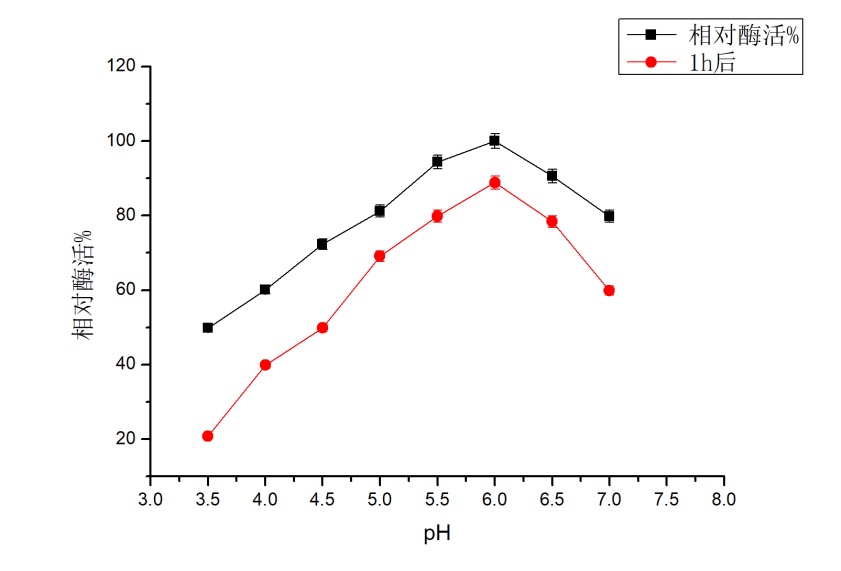
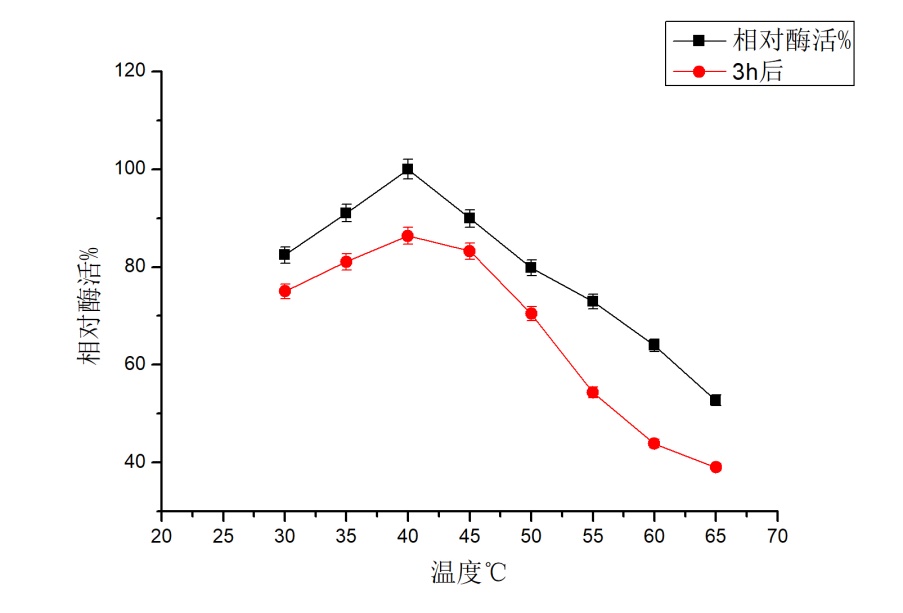
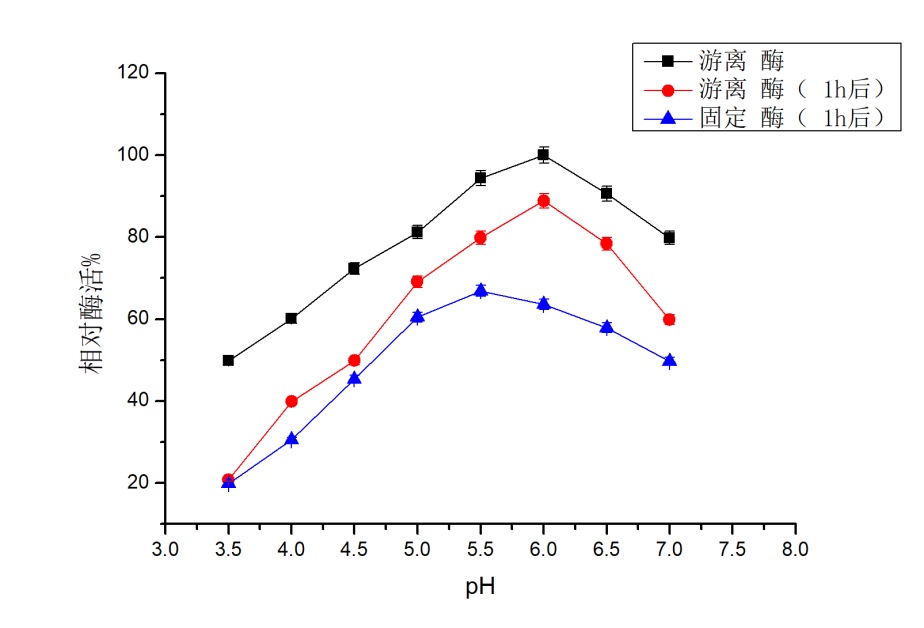
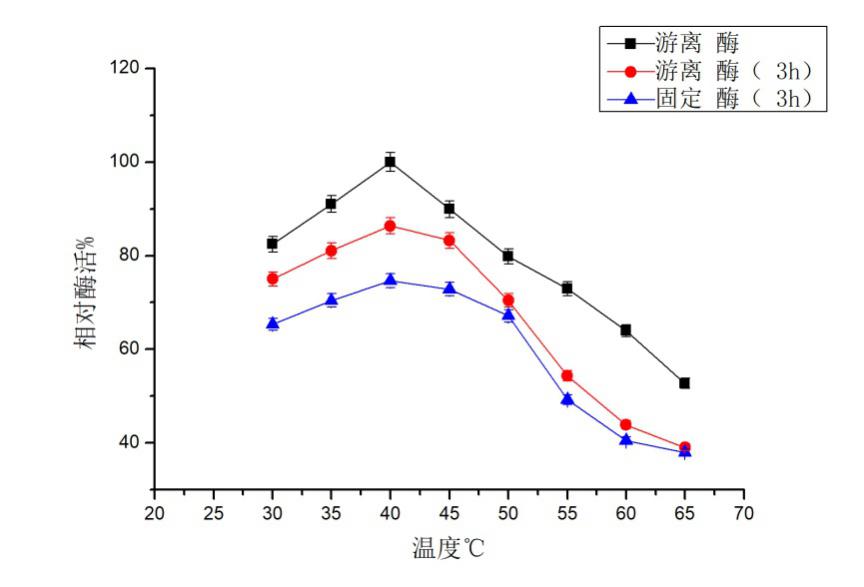
在pH 5.6下,固定化前酶活力37.96 U/ml ,固定化后酶活力为28.65 U/ml,酶活损失率约为24.59 %。 固定化后最适pH为5.5,与固定化前6.0有所差异。整体上,酶活有所降低,但固定化后其反应的pH范围有所增大。固定化酶后其最适反应温度仍为40 ℃。整体上,其酶活有所下降,但在30-50 ℃时,保存3 h后,其酶活仍能达到游离酶最高酶活的60 %以上;同时,在30-50 ℃时,其酶活保持一定的稳定性,其适宜的反应温度范围有所扩大。
关键词:酸性磷酸酯酶 纯化 静电纺丝 酶学性质 固定化酶
ABSTRACT
Acid Phosphatase (AP, EC3.1.3.2) is a nonspecific Phosphatase that hydrolyzes phosphate monoester bonds under acidic conditions.Under low phosphorus stress or extreme drought, AP can hydrolyze phosphate groups of substrate for plant absorption and utilization [1].Currently, this enzyme catalysis principle has been developed into a biosensor device for the detection of certain pesticide residues and heavy metal residues, etc. [2].
In this study, enzyme extraction and purification technology, polymer material preparation and electrostatic spinning technology were used to achieve the immobilization of acid phosphatase, so as to facilitate subsequent continuous reaction and product development. The purpose of this paper is to improve the temperature stability and acid-base stability of immobilized enzyme while reducing the loss of enzyme activity as much as possible, so as to establish the enzyme immobilization technology methodology, for subsequent various immobilization carrier materials of testing effect as well as the related products research and development to provide real and reliable experimental data.
The contents of this study included :(1) culture, crushing and enzyme purification of bacillus subtilis (B. subtilis WB800/pMA5-Acp);(2) basic enzymatic properties of acid phosphatase;(3) preparation of ACP PVP nanofiber membrane;(4) study on the enzymatic properties of immobilized enzyme.
ACP was successfully purified by Ni column and showed a pure single strip with a molecular weight of about 26 kDa after SDS-PAGE electrophoresis. The purified enzyme activity was 37.96 U/ml, and the specific activity (the number of enzyme activity units of 1 mg protein) was 128.24 U/mg., and the purification multiple was up to 19.57 times. The enzyme optimum reaction pH 6.0, in 4 ℃ after 1 h, pH 5.5-6, residual enzyme activity basic remained stable. After optimum temperature and thermal stability experiments, it is concluded that the optimal reaction temperature of 40 ℃, the enzymes in the corresponding temperature warm bath after 3 h, 30 to 45 ℃, the nature of the enzyme, the more stable enzyme activity decreased less.
At pH 5.6, the enzyme activity was 37.96 U/ml before immobilization, 28.65 U/ml after immobilization, and the enzyme loss rate was about 24.59 %.The optimal pH after immobilization was 5.5, which was different from 6.0 before immobilization. Overall, the enzyme activity decreased, but the pH range of the reaction increased after immobilization. Immobilized enzyme after its optimum reaction temperature still is 40 ℃.Overall, the enzyme activity decreased, but in the 30-50 ℃, save after 3 h, the enzyme activity can still achieve free enzymes more than 60% of the highest enzyme activity; At the same time, in the 30-50 ℃, the enzyme activity to maintain certain stability and the appropriate reaction temperature range has expanded.
Key words: acid phosphatase;purification; electrostatic spinning;enzyme properties;immobilized enzyme
目 录
摘 要 I
ABSTRACT II
第一章 文献综述 1
1.1酸性磷酸酯酶 1
1.2酸性磷酸酯酶生化特性 1
1.3酸性磷酸酯酶底物特异性 1
1.4固定化技术与静电纺丝 2
1.5 高分子材料之PVP 2
1.6 前景应用 3
1.6.1前列腺癌预测 3
1.6.2调运磷酸盐 3
1.6.3骨骼疾病 3
1.6.4传感装置 3
1.7实验研究目的 4
第二章 酸性磷酸酯酶纯化及酶学性质研究 5
2.1 材料与方法 5
2.1.1 实验材料 5
2.1.2 实验仪器 5
2.1.3 实验试剂 6
2.1.4 实验缓冲液 6
2.1.4 实验培养基 7
2.2 实验方法 7
2.2.1 菌种复壮 7
2.2.2 菌株复性 7
2.2.3扩大培养 8
2.2.4超声破碎与过滤膜 8
2.2.5 Ni-NTA纯化 8
2.2.6 SDS-PAGE分析 8
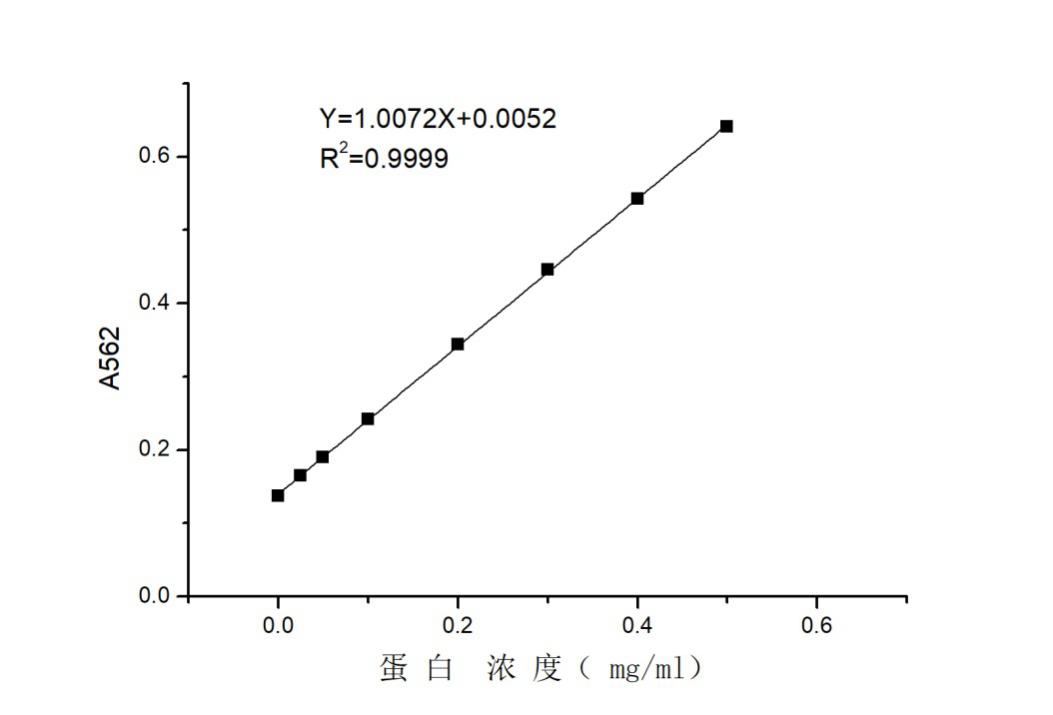
2.2.7 蛋白浓度标曲制作与测定 9
2.2.8酶活标曲制作与测定 9
2.2.9酶学性质研究 9
2.3 实验结果与分析 10
2.3.1 酶纯化和酶活力测定 10
2.3.2 酶学性质研究 12
2.4 本章小结 14
第三章 酸性磷酸酯酶的固定化 15
3.1 实验材料和仪器 15
3.1.2 实验仪器与试剂 15
3.2 实验方法 15
3.2.1 ACP/PVP载体的制备 15
3.2.2 固定化酶的酶活力测定 15
3.2.3 固定化酶酸碱稳定性测定 16
3.2.4 固定化酶温度稳定性测定 16
3.3 实验结果与分析 16
3.3.1 固定化前后酶活损失 16
3.3.2固定化前后酸碱稳定性 16
3.3.3固定化前后温度稳定性 17
3.4 本章小结 18
第四章 结论与展望 19
4.1 结论 19
4.2 展望 19
参考文献 21
致谢 24
第一章 文献综述
1.1酸性磷酸酯酶
酸性磷酸酯酶(Acid Phosphatase,AP,EC3.1.3.2)是一种非特异性磷酸酯酶,能够在酸性条件下水解磷酸单酯键[1]。在植物低磷胁迫或是极度干旱时,AP可水解底物磷酸基团供植物吸收利用。现已有利用其催化原理开发出生物传感器并应用于某些农药残留、重金属残留的快速检测[2]。在医学领域,血清酸性磷酸酯酶还应用于人体前列腺癌,原发性肿瘤,恶性肿瘤骨转移等疾病的早期诊断。
1.2酸性磷酸酯酶生化特性
酸性磷酸酯酶最适pH为5.0~5.5,如人体前列腺AP最适反应pH为5.5~7.0[3]。同时,人肝脏AP在以核黄素-5-磷酸为底物时,最适反应pH 5.0[4]。最适反应温度为37 ℃,面包果纯化后的AP在55 °C保留50 %的活性,37°C 2.5 h保存后仍保持活性[5]。金属离子对其催化活性影响为:不能被Mg2 所活化,氟化物[22]、Hg2 、Cu2 等金属离子会抑制植物叶子纯化的AP的活性[6][21]。由于固定化酸性磷酸酶催化特性不同于自由酶,Rao[7]等人发现固定化酶中氢氧化铝的存在通常能改善酸性磷酸酯酶的性质。
1.3酸性磷酸酯酶底物特异性
酸性磷酸酯酶也可以分解一些特殊的有机磷底物,产物可以显现特异的颜色。如 5-溴-4-氯-3-吲哚磷酸盐(BCIP,蓝色)、萘酯磷酸盐[8](β-NAP,紫红色)、对硝基酚磷酸二钠(pNPP,黄色)。通过反应产物颜色的深浅,在分光光度计比色,可以判断酸性磷酸酶的活性高低进而实现半定量或定量分析。本研究将使用磷酸苯二钠作为特异性底物进行反应测量酶活。磷酸苯二钠在ACP催化后可产生较为简单的产物——苯酚与磷酸氢二钠,在碱性条件下可用Folin-酚法对产物酚含量进行定量定性分析。
1.4固定化技术与静电纺丝
固定化技术是通过化学或物理方式在有限的空间内定位游离微生物,以提高微生物细胞或分子的浓度,保持较高的生物活性和再利用的一种方法[9]。常用的固定化技术包括物理吸附法、化学结合法、交联剂结合、包埋法等[26][27][10]。固定化技术存在很多的优势,如可以反复利用,保持较高活性,便于使用研究,节约成本等;同时也存在一定劣势,如固定化过程酶活可能会损失,固定化效率会不理想。
静电纺丝是利用高压静电作用制备纳米纤维的一种方法,其原理是利用高压静电使高度带电聚合物溶液或熔体在高压电场下细化,然后通过溶剂蒸发或冷却和凝固融化固化,最后在接收板上接收膜状纳米纤维[11]。此技术的优势在于其能运用的高分子材料范围特别广,无论是通用高分子,导电高分子,生物高分子,都可以纺成相应的纳米级薄膜。同时这种纳米纤维不仅是在于细而且纤维是连续的,甚至长达几米上千米。
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: