可成像的远红/近红外共轭聚合物光敏剂,聚集诱导发射用于图像引导的癌细胞消融外文翻译资料
2023-01-05 14:14:14
可成像的远红/近红外共轭聚合物光敏剂,聚集诱导发射用于图像引导的癌细胞消融
原文作者:吴文波,冯光学,徐士,刘斌
摘要:远红(FR)/近红外(NIR)光敏剂在图像引导的光动力癌症治疗中是非常理想的。这里,聚(1,2-双(4-((6-溴己基)氧基)苯基)-1,2-二苯基乙烯-共-交替-9,10-蒽醌)(ATP)活性基团为电子给体,四苯基乙烯(TPE)为活性基团,以蒽醌(AQ)为受体,首次通过一锅法Suzuki聚合制备了PTPEAQ(PTPEAQ)PTPEAQ与嵌段共聚物接着用抗-Her2亲和体表面官能化产生PTPEAQ-NP-HER2。它在可见光照射下显示出明亮的AIE活性的FR/NIR发射和高效的单线态氧产生,已经成功地用于使用SKBR-3细胞(一种在细胞膜上具有HER2过表达的乳腺癌细胞)的光动力学癌细胞消融。
介绍
近几十年来,共轭聚合物(CPs)已被广泛用于生物传感,生物成像和光动力疗法(PDT)。具有图像引导疗法理想功能的CPs的发展代表了一个新的研究方向。在单一聚合物链中光发射和光敏化的组合已经引起了杀生物研究和癌细胞消融的极大研究兴趣。理想的光敏剂应发出可光稳定的FR/NIR(在650-900nm范围内)的荧光,并在光照下产生足够的活性氧(ROS)以杀死癌细胞。到目前为止,大多数纯光敏剂在蓝色或绿色区域都具有发射性,短发射波长使得它们不适用于体内应用。部分解决该问题的一个策略是将FR/NIR光敏剂(例如卟啉)连接到CP侧链或骨架上。然而,当FR/NIR光敏剂的浓度高或聚合物以聚集态存在时,ROS生成能力大大降低。此外,目前的CP光敏剂的光稳定性仍然是一个问题,因为CP链可以在一定程度上被产生的单线态氧(1 O2)分解。通过开发在可见光区具有强吸光性的CP光敏剂,有效的ROS生成以及用于图像引导治疗或癌细胞消融的稳定的NIR发射。
为了实现具有FR/NIR发射的CP,最有效的策略之一是将强的供体和受体单元引入到聚合物中,以便可以利用聚合物骨架的强电荷转移特性。一般来说,这些FR/NIR CPs的量子产率(QYs)远低于蓝色或绿色。由于强电荷转移可能引起极性介质中的荧光猝灭,QYs在进入水中时可以进一步降低。解决这一问题的有效策略之一是形成纳米粒子(NPs),其将聚合物光敏剂封装并将其引入水性介质中。在这些NP中,聚合物基质的疏水端将包裹CP并提供保护壳,或多或少地将它们与氧和水侵入分开,从而在水性介质中产生改善的QY。然而,当CP被封装到NP中时,众所周知的聚集引起的发射猝灭(ACQ)效应起作用,从而猝灭整个荧光。聚集也可以降低聚合物NPs的ROS生成能力。
另一方面,聚集诱导的发射(AIE)表现出相反的现象:在稀溶液中一系列非常微弱的发射或不发射分子被诱导以通过聚集形成而有效地发射。大多数疏水性AIE染料可以发出强烈的荧光作为水性介质中的聚集体,无论其发光颜色如何。在我们最近的工作中,我们报道了AIE光敏剂NPs的ROS产生能力很强。
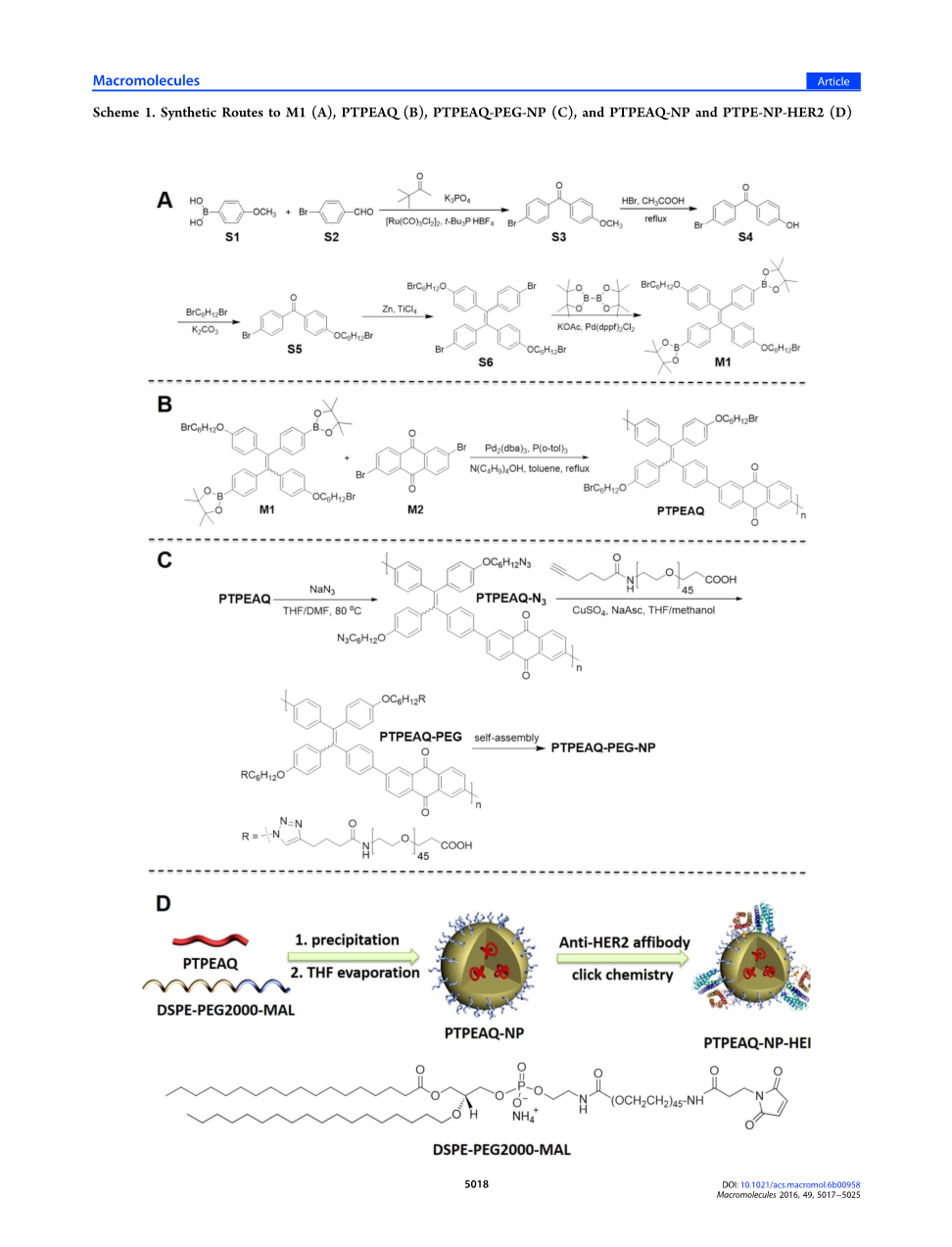
方案1.合成M1(A),PTPEAQ(B),PTPEAQ-PEG-NP(C)和PTPEAQ-NP和PTPE-NP-HER2(D)。这促使我们设计和合成一种AIE活性的FR/NIR CP光敏剂,以测试其是否能够继承FR/NIR AIE光敏剂的良好性能,但是具有改进的材料可加工性。
在这篇文章中,我们报道了具有AIE特性和良好的ROS生成能力的新型FR/NIR CP的设计和合成。四苯基乙烯(TPE)是标志性的AIE活性基团之一,迄今报道的几乎所有含有TPE基团的CP都是AIE活性的(图S1显示了一些例子)。另一方面,已经开发了蒽醌(AQ)来构建具有非常小的Delta;Est值(最低单重态(S 1)和最低三重态(T 1)之间的能隙)的FR/NIR染料1))(ChartS2)。小Delta;Est值将有利于系统间交叉(ISC)过程,这可能在光照射下产生有效的1 O2。在这个贡献中,通过使用TPE作为电子供体,AQ作为电子受体,已经制备了PTPEAQ的新CP(方案1)。正如预期的那样,从TPE到AQ的强电荷转移使聚合物FR/NIR发射,并且聚合物也继承了TPE的AIE特性。而且,聚合物具有耐光性,在白光照射下可以产生高效的1 O2。随后,制备两种类型的PTPEAQ-PEG-NP和PTPEAQ-NP的NPs以将PTPEAQ引入水性介质中用于图像引导的癌细胞消融。我们发现这两种NPs具有不同的荧光强度和ROS生成能力,抗HER2亲和功能化的PTPEAQ-NPs可以选择性靶向SKBR-3癌细胞进行图像引导的癌细胞消融。
实验部分
材料和仪器
1,2-二硬脂酰-甘油基-3-磷酸乙醇胺-N-[马来酰亚胺(聚(乙二醇))-2000](DSPE-PEG 2000-Mal)由Avanti Polar Lipid,Inc.(Alabaster,AL)提供。Hoechst 33342和二乙酸荧光素(FDA)购自Invitrogen。胎牛血清(FBS)由Gibco(Lige Technologies,瑞士)提供。抗HER2 Affibody从affibody(Solna,瑞典)购买。四氢呋喃(THF)在使用前立即在干燥的氮气下从二苯甲酮羰基钠蒸馏。pH=7.4的超纯级10times;磷酸盐缓冲盐水(PBS)缓冲液购自BASE Singapore。Milli-Q水由Milli-Q Plus系统(Millipore Corporation,Bedford,MA)提供。SKBR-3乳腺癌细胞和NIH-3T3正常成纤维细胞购自美国典型培养物保藏中心。所有其他化学品和试剂购自Sigma-Aldrich并按原样使用。
使用四甲基硅烷(TMS;delta;=0ppm)作为内标,在Bruker Avance 600光谱仪上测量1H和13C NMR谱。使用Waters 996光电二极管检测器和Phenogel凝胶渗透色谱柱,使用聚苯乙烯作为标准,THF作为洗脱液,以1.0mL/min的流速进行尺寸排阻色谱(SEC)分析。使用衰减全反射傅里叶变换红外光谱(ATR-FTIR)在Nicolet iS 50 FT-IR光谱仪上记录在4000-400cm-1的范围内,分辨率为4cm-1,平均32次扫描。分别使用Shimadzu UV-1700和PerkinElmer LS 55光谱仪记录UV-vis和光致发光光谱。用Zetasizer Nano S(Malvern Instruments Ltd.,Worcestershire,UK)在室温下通过激光散射(LLS)测量流体力学直径和尺寸分布。
(188.4mg,0.20mmol),蒽醌类单体M2(72.2mg,0.20mmol),三(二亚苄基丙酮)二钯(0)(3.0mg)和三(邻甲苯基))膦(6.0mg)在氮气下溶于甲苯(8mL)和20%四乙基氢氧化铵水溶液(2mL)的混合物中。在氮气氛下剧烈搅拌混合物回流40小时。冷却至室温后,将混合物倒入甲醇中。将所得固体溶于THF中,滤出不溶固体。将滤液浓缩并沉淀到甲醇中,然后将所得固体用丙酮洗涤,得到红色固体状的PTPEAQ(142.2mg,产率79.3%)。(TMS,ppm):1.4-1.5(-CH 2-),M w=(-CH 2-),1.8-1.9(-CH 2-),3.3-3.5(-CH 2 Br-),3.8-4.0(-OCH 2-),6.6-6.7(ArH)(ArH),7.1-7.2(ArH),7.4-7.6(ArH),7.9-8.0(ArH),8.2-8.4(ArH),8.4-8.5(ArH)。13C NMR(150MHz,3,298K):(ppm)24.4,25.3,28.0,29.1,32.7,33.8,59.3,67.6,76.8,77.0,77.2,113.9,125.2,126.6,127.2,128.0,131.9,132.2,132.6,135.7,139.7,145.0,157.8,157.
Ps的合成。为了制造PTPEAQ-NP,将含有1mg PTPEAQ和2mg DSPE-PEG 2000-Mal的THF混合物倒入10倍稀释的水中。然后使用12W输出的微尖超声波超声仪(XL2000,Misonix Inc.,Farmingdale,NY)超声处理THF/水混合物2分钟。通过在通风橱中搅拌所获得的悬浮液来蒸发THF过夜,通过0.2mu;m注射器驱动的过滤器过滤获得PTPEAQ-NP(10mL,基于PTPEAQ质量浓度为0.1mg/mL)。为了合成PTPEAQ-PEG-NPs,按照对PTPEAQ-NP的相同程序使用PTPEAQ-PEG的纯THF溶液,而不添加DSPE-PEG-Mal。
PTPEAQ-NP-HER2的合成。为了合成PTPEAQ-NP-HER2,将制备的PTPEAQ-NP悬浮液(6mL)与半胱氨酸修饰的抗HER2亲和体(500mu;g/mL,100mu;L)混合,并在室温下保持12小时。点击化学反应发生在PTPEAQ-NP表面马来酰亚胺基团和亲和体上唯一的硫醇基团之间。使用分子截断值为100000kDa的离心过滤器离心以去除过量的亲和体后,收集PTPEAQ-NP-HER2(6mL,基于PTPEAQ质量浓度为0.1mg/mL)用于进一步研究。
细胞培养。将SKBR-3和NIH-3T3细胞在含有10%FBS和1%PS的Dulbecco改良的Eagle培养基(DMEM)中于37℃,5%CO2的潮湿环境中培养。在实验之前,将细胞预培养直至达到汇合。
细胞成像。将NIH-3T3细胞和SKBR-3细胞接种于8孔培养箱(LAB-TEK,Chambered Coverglass System)37℃,80%铺满后用1times;PBS缓冲液清洗两次.PTPEAQ-NP-HER2 10微克/毫升)悬浮于DMEM中,然后加入这些孔中。将细胞温育2小时,然后用1times;PBS缓冲液洗涤细胞两次。随后用Hoechst33342(5mu;g/mL)孵育细胞20分钟。用1times;PBS缓冲液洗涤两次后,通过共焦激光扫描显微镜(CLSM)对细胞进行成像。
细胞毒性研究。采用MTT法检测SKBR-3和NIH-3T3细胞在不同处理条件下的生存能力。两种细胞以4times;104个细胞/mL的强度接种在96孔板(Costar,Chicago,IL)中。培养24小时后,将细胞与不同浓度的PTPEAQ-NP-HER2 DMEM悬浮液温育2小时。用含有10%FBS和1%PS的新鲜DMEM代替PTPEAQ-NP-HER2悬浮液。将所选的孔暴露于白光照射(60mW/cm 2)5分钟。所有细胞进一步培养24小时,然后用1times;PBS缓冲液洗涤。将新鲜制备的浓度为0.5mg/mL的MTT溶液以每孔100mu;L的体积加入到96孔板中。温育3小时后,用过滤的DMSO(每孔100mu;L)代替MTT溶液。将平板轻轻摇动10分钟以溶解所有形成的晶体。通过酶标仪(Genios Tecan)测量的570nm处的MTT吸光度可以获得细胞存活力。仅用培养基处理的受控细胞被任意确定为具有100%细胞活力。
活细胞染色。SKBR-3细胞在8孔培养箱中培养,80%融合后用PTPEAQ-NP-HER2(20mu;g/mL)悬浮细胞培养液处理2h。然后用1times;PBS缓冲液洗涤细胞两次,然后将所选孔暴露于不同照射下的白光照射(400-1000nm,60mW/cm2)。光照处理后,将细胞与FDA(100mu;g/mL)进一步孵育10分钟以活细胞染色。用缓冲液洗涤两次后,通过CLSM成像细胞。
结果与讨论
Delta;Est的合成与理论计算PTPEAQ的合成路线示于方案1中。在第一步中,按照所报道的方法由(4-甲氧基苯基)硼酸(S1)和4-溴-苯甲醛(S2)以65.6%制备二苯甲酮衍生物S3。42将化合物S3中的甲基在HBr溶液中除去,得到化合物S4,将其进一步用1,6-二溴己烷改性得到化合物S5。随后通过McMurry烯化以68.6%产率合成溴化物官能化的TPE S6。化合物S6和4,4,4,4,5,5,5,5-八甲基-2,2-双(1,3,2-二氧杂硼杂环戊烷)之间的进一步反应产生了基于TPE的单体M1,为产率为46.4%的白色固体。在最后一步中,通过单体M1与基于AQ的单体M2之间的钯催化的Suzuki聚合制备目标聚合物PTPEAQ,产率为79.3%。通过沉淀纯化后,PTPEAQ易溶于普通有机溶剂,如甲苯,四氢呋喃等。我们还制备了另一种具有相似结构的聚合物(方案S1在Support Information中),但仅得到不溶性沉淀物。聚合中使用的所有反应条件完全相同,只是使用不同的基于TPE的单体。烷基在TPE单元中的位置是两种单体之间的唯一差别,这表明了CP侧链中烷基对于调节溶解度的重要性。
为了赋予PTPEAQ水分散性以用于生物应用,制备不同的NP以将其引入水性介质中(方案1C和1D)。在第一种策略中,PEG与PTPEAQ的侧链直接连接以产生PTPEAQ-PEG,其在水性介质中自组装以形成PTPEAQ-PEG-NP(方案1C)。在第二种策略中,使用两亲性聚合物DSPE-PEG 2000-Mal(化学结构如流程1D所示)作为基质来包封PTPEAQ聚合物,产生具有与PTPEAQ链缠绕的疏水片段(DSPE部分)的PTPEAQ-NP
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 9 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[281143],资料为PDF文档或Word文档,PDF文档可免费转换为Word




