β-氟烷基化不饱和砜的合成及催化环加成反应研究毕业论文
2020-04-06 11:11:08
摘 要
三氟甲基是一个非常重要的基团。由于氟原子的电负性高,所以三氟甲基具有很强的吸电子诱导效应,并且含有稳定的碳-氟键。氟甲基化合物的化学和生物稳定性,亲油性,极性等都会显着增加,所以三氟甲基被广泛应用于医药,农药等领域。因此,如何有效地构筑含有三氟甲基的化合物具有十分重要的意义。
本文主要分为三个部分:(1)第一部分主要介绍了含氟化合物研究背景,主要有直链化合物上的氟化反应、芳(杂)环上的三氟甲基化合物合成、以及双官能团三氟甲基化合物合成,然后介绍了含砜基氟化合物的合成,之后介绍了1,3-偶极环加成反应;(2)第二部分基于文献背景和本课题组研究基础,设计合成了一类新型含三氟甲基苯基砜化合物;(3)第三部分探索了含三氟甲基苯基砜化合物与甲亚胺叶立德之间的环加成反应,分别考察了环加成反应取得较好的产率和非对映选择性,以及中等的对映选择性的结果。
本文以三氟乙酸乙酯和苯硫酚作为反应起始原料,先将苯硫酚甲基化,再将巯基氧化为砜基,进行链增长,还原消去后,得到了β-氟烷基化不饱和砜,产物的结构经过核磁共振氢谱检测。此外,本文还以这种化合物为底物,探究了其与甲亚胺叶立德的环加成反应,为下阶段进一步优化结果奠定重要基础。
关键词:三氟甲基;不饱和砜;1,3-偶极环加成;甲亚胺叶立德
Abstract
Trifluoromethyl is a very important group. Due to the high electronegativity of the fluorine atom, the trifluoromethyl group has a strong electron-withdrawing induction effect and contains a stable carbon-fluorine bond. The chemical and biological stability, oleophilicity, polarity, etc. of fluoromethyl compounds will increase significantly, so trifluoromethyl is widely used in medicine, pesticides and other fields. Therefore, how to effectively construct a compound containing a trifluoromethyl group is of great significance.
This article is mainly divided into three parts: (1) The first part mainly introduces the research background of fluorinated compounds, mainly including fluorination reaction on linear compounds, synthesis of trifluoromethyl compounds on aromatic (hetero) rings, and dual functional groups. Synthesis of trifluoromethyl compounds, followed by synthesis of sulfone-containing fluorochemicals, followed by 1,3-dipolar cycloadditions; (2) Design and synthesis of the second part based on the literature background and the research basis of this group. A new class of trifluoromethyl phenyl sulfone compounds was included; (3) Part III explored the cycloaddition reaction between the trifluoromethyl pyridine sulfone compound and azomethine ylide. The results of the cycloaddition reaction with good yield, diastereoselectivity, and moderate enantioselectivity were investigated.
In this paper, ethyl trifluoroacetate and thiophenol were used as the starting materials for the reaction. The thiophenol was first methylated, then the mercapto group was oxidized to the sulfone group, chain growth was achieved, and the α-fluoroalkylation was obtained after reduction and elimination. Unsaturated sulfone, the structure of the product was examined by nuclear magnetic resonance spectroscopy. In addition, this article also uses this compound as a substrate to explore its cycloaddition reaction with azomethine ylide, which lays an important foundation for further optimizing the results in the next stage.
Keywords: trifluoromethyl; unsaturated sulfone; 1,3-dipolar cycloaddition; azomethine ylide
目录
1绪论 1
1.1 目的及意义 1
1.2国内外研究现状 3
1.2.1含氟化合物的合成 3
1.3含砜基含氟化合物的合成 10
1.4 1,3偶极环加成反应 13
2 设计思想 16
2.1三氟甲基化合物的研究背景 16
3 实验部分 18
3.1实验仪器以及药品 18
3.1.1实验仪器 18
3.1.2实验药品 18
3.2 β-氟烷基化不饱和砜和亚胺的合成 19
3.2.1 β-氟烷基化不饱和砜的合成路线 19
3.2.2 β-氟烷基化不饱和砜的合成 20
3.2.3 甲亚胺叶立德的合成 22
3.2.4 β-氟烷基化不饱和砜的催化环加成反应 23
4总结与展望 25
1绪论
- 目的及意义
将氟原子或是氟官能团引入有机分子通常会使得这些化合物表现出特定的生理活性或特殊的物理化学性质。含有氟元素的化合物之所以具有如此特殊的性质,一般认为是由于氟原子自身的特殊性质以及这些化合物中含有的C-F键的特殊性质所决定。
- 氟原子的van. Der. Waals半径介于氢原子的van. Der. Waals半径和氧原子的van. Der. Waals半径之间(rH=1.20Å,rF=1.47Å,rO=1.52Å)。因此,有机分子中的氢原子被氟原子替换的结果就是,整个有机分子大小变化不明显,因此不易被细胞内的特定的酶识别,所以可以代替不含氟的化合物参与到生物体代谢过程中,这种特性被称作“伪拟效应”。正是因为这种特性,氟原子在生物、医药领域的地位举足轻重。
- C-F键是有机物中很稀少的性质非常稳定的化学键,碳氟键键能为456/mol,相对于常见的碳氢键的键能356/mol,碳氟键的断裂非常难。含氟基团能够经历新陈代谢中的大部分变化而不会转化,从而阻止潜在的有毒副产物的形成,提高药物的安全性以及其作用时长。
- 氟是元素周期表中理论上电负性最大的元素,这一性质也已经被验证。分子的电子云分布,偶极矩以及含氟基团的相邻原子或基团的酸度和碱度都会因为分子中引入氟原子的显著变化。进而改变有机分子的化学反应性能以及物理性质。
- 分子脂溶性也会被分子中的氟元素影响,再加上人体的细胞膜具有高亲 脂性,因此含氟药物在生物体内更容易被吸收、传输和扩散。已有研究,某些生物大分子,例如蛋白质,在其中引入了含氟的官能团后,蛋白质空间性质以及蛋白质之间的相互作用都会被改变,从而使得蛋白质的生理性质被改变[1]。
虽然说氟元素是在自然界中丰度最大的卤素,然而自然界中参与到生物体代谢过程且能稳定存在的含氟有机化合物种类却数量有限[2-4]。人工合成制备含氟有机分的主要方法一直是有机化学中一块非常活跃的领域。根据几年前对氟化合物市场的统计,氟元素存在于20%的医药中和30-40%的农药中,继氮原子之后,氟已然被视作生命研究领域的第二最佳杂原子[5]。
氟是化学周期表中较为特殊的一种元素,氟原子具有“伪拟效应”、电负性高、亲脂性强等独特的性质,这些性质对化合物生物活性影响巨大[6]。大量含氟的化合物具有很特别的性质,例如常见的聚合物、液晶材料以及其他常见的人工材料等,由于其结构中的氟原子从而使其具有相应的独特性质[7]。另外,化合物分子中引入的氟原子会使这些化合物在原有基础上新增一些特殊性质。例如,含氟药物效果比无氟药物更有效,含氟的材料比不含氟的材料更耐腐蚀以及耐磨损,其中在生活中非常常见的材料:PTFE;另外含氟化合物在农药方面的应用也早已引起了我国科学家的注意,我国“八五”,“九五”农药发展计划期间,研究开发了多种新品种的农药,大概五分之一的研究项目与氟相关。
含氟有机化合物具有以下几种性质:高生理活性、稳定性以及疏水性(除外一些碳原子数目较少的化合物),同时这种化合物的表面活性根据含氟原子数目的增加而增大,并且热物理性能和介电性能都会发生一定程度的变化,还会从脂溶性转变为疏油性,这些特殊性质使有机氟化合物在精细化工领域内受到广泛应用。在生物活性化合物中引入氟原子或者含氟官能团通常可以非常有效地对其生物活性进行改良[8]。
化合物分子最多被引入且最常见的含氟官能团是三氟甲基。这个含氟功能基的疏水性很强,也是已知的官能团中脂溶性最强的基团,其生物通透性和靶向选择性在活性基团中也属于佼佼者[9]。正是由于三氟甲基具有的吸电子诱导效应,且其中的C-F键也比较稳定,因此分子生物活性和代谢稳定性、亲脂性、酸碱性、偶极距、极性以及在细胞膜中的渗透性都会因为氟烷基的引入在一定程度上有所增强,因此在精细化工领域含氟烷基的化合物被广泛应用[10],如:常见的除草剂磺酰苯胺类、常见的医用减肥药苯丙胺、抗寄生虫类药物伯唑、单偶氮染料,在这些化合物中引入氟烷基会使得这些化合物的良性效果增强5-10倍不等 [11]。
并且,近年来,对于三氟甲基的研究工作已经更为深入,早已不是停留在简单的引入三氟甲基的阶段,含手性碳的三氟甲基化合物就是近年研究热点,也是非常实用的含氟化合物的拓展,具有手性碳中心的含三氟甲基化合物,能够根据所需的空间结构合成具有光学活性的三氟甲基化合物(直链,环状)[12],而且这类含有三氟甲基的化合物在手性碳中心周围可以不含任何杂原子;当然还存在其他的含三氟甲基化合物的衍生物,这些化合物可以通过常见的人名反应制得(如Micheal加成等)。也可以特意在手性中心周围引入另外的对分子性质影响较大且易于引入或是转换的基团,例如:乙烯基砜。Lewis碱与金属催化剂都是亲电子体,而砜基氧上有大量的孤对电子,因此砜基上的氧原子可以与上述两者进行双螯合,直接增强了催化剂与底物的结合,固定了反应中间体的空间结构,实现了稳定中间体,加快反应速率的目的。这一性质为手性金属催化剂的识别、活化提供便利,从而更有效地的实现了对映体结构的高度筛选作用;含有这种特殊基团的化合物也被用作Michael反应的电子受体以及乙烯基阴离子的前驱体,因为含有砜基的手性助剂易于引入,也容易消除[13]。
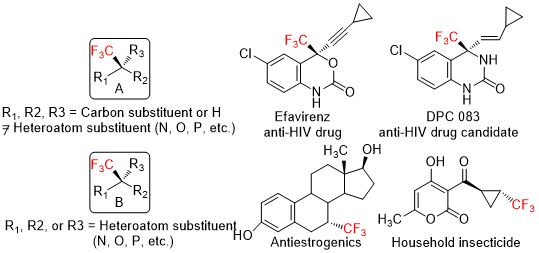
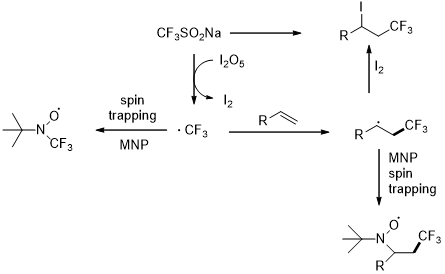
图1 两种含CF3砌块的手性碳中心
根据手性中心周围的官能团或是原子的不同,含手性中心的氟烷基化合物可以分为如图1中所示两类:(1)与手性碳中心相连的杂原子或含杂原子基团,如图1中的A结构式及一些药物的结构代表;(2)手性碳中心只和碳、氢相连,不含其他任何杂原子或是杂原子官能团,如图1中的B结构式及一些药物的结构代表。
近些年来,催化不对称反应的研究非常热门,因此很多性能优良的手性催化剂被开发出来,反应底物的类型和范围也被大幅度的增大了。发展创新的含有氟烷基手性砌块前手性有机物,同时应用成熟的不对称催化反应建立全碳手性中心,已成为世界上很多学者的研究热点,这种标准逐渐成为了评价一类手性催化剂体系是否有效的常用方法[14]。
这种含有手性中心的氟烷基化合物的构建可以使用偶极环加成反应,构建含五元杂环化合物的方法普遍认为有两种形式([1 4], [3 2]),而这两种形式中,使用最为广泛研究又较为成熟的为后者,[3 2]是1,3-偶极环加成反应最为常见的加成模式,也因此在天然五元环化合物的合成或是人工五元环化合物的制备中都非常常见。构建五元环的同时, 1,3-偶极环加成反应也可以决定目标产物空间构型、非对映体构型或者映体构型,因此如何改善提高反应的选择性,从而高选择性地得到所需的具有特定结构的目标产物或是得到ee值令人满意的化合物是这种环加成反应的研究重点以及待攻克的难点。
1.2国内外研究现状
1.2.1含氟化合物的合成
向化合物中引入氟元素需要用到氟化试剂,分为亲核氟化试剂与亲电氟化试剂(图2、3),
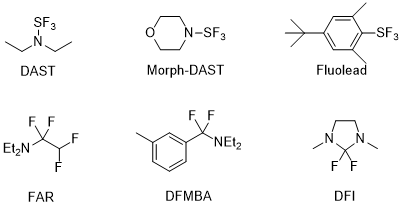
图2 亲核氟化试剂
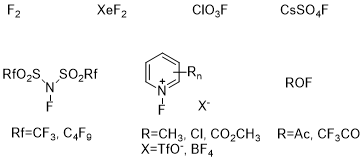
图3 亲电氟化试剂
向化合物中引入氟元素有三种方式:
(1)苯环上的氟化
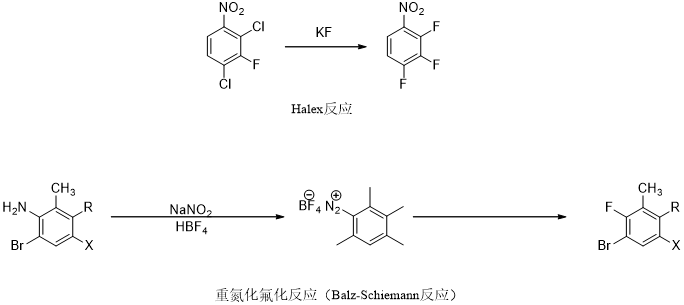
图4 芳香环上的氟化
(2)亲电氟化反应;
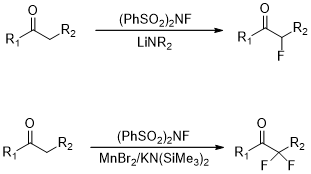
图5 亲电氟化反应
(3)直接氟化反应。
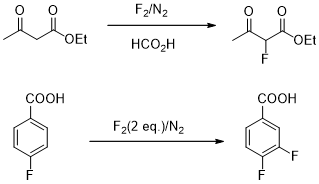
图6 直接氟化反应
1.2.1.1 C-C含氟化合物的合成
为了引入含氟基团,最早的研究是二氟烷基的引入,常见常用的加入二氟烷基的试剂有含氟锌试剂,见(图8)。但由于二氟烷基的引入局限性太大,进一步的底物拓展被限制,因此对于二氟烷基的引入没有更多的研究。
图8 二氟烷基的引入
接下来就是氟烷基的引入了,氟烷基的引入也进过了多个发展阶段,最早报道与1999年,这个阶段研究最多的氟烷基化试剂是Ruppert试剂,这一阶段的氟烷基化反应虽然在底物上要求没有太多限制,但是大多条件苛刻,或是反应时间过长,再加上Ruppert试剂的低沸点,毒性较大。较为危险,因此这种氟烷基化方法不适合用于实践。但不可否认是引入氟烷基的一个里程碑式的进步。
将氟烷基引入分子中的方法有很多,最常用机理也较简单的就是亲核反应,早期氟烷基化试剂中研究最频繁的为Ruppert试剂(三氟甲基三甲基硅烷),前文中已经提到氟原子是元素周期表中电负性最大的元素,这种极度缺电子的性质导致Si-CFs键被弱化,而后经由氟原子的诱导,Si-CFs键处于容易裂解的状态,产生-CF3。作为亲核离子进攻分子的亲电碳中心,实现氟烷基官能团的转移,从而将氟烷基引入到各种有机物中[15]。
Blazejewski等[16]使用Ruppert试剂和底物亚胺成功的进行了氟烷基化反应,将圆底烧瓶置于氩气氛围的保护下,室温下将氟化铯和亚胺加入到溶剂THF中,混合均匀后,缓慢加入N-三甲基硅烷基咪唑,最后将三氟甲基硅烷加到搅拌的反应液,反应持续一天,之后硅溶胶被加入,最终向反应器中滴入数滴2M的浓盐酸调节体系的pH值,继续反应4h,过滤,用少量乙醚洗涤、加热浓缩,然后用柱层析法分离产物,5%~10%乙醚的戊烷溶液作为洗脱剂,获得双三氟甲基化的亚胺。
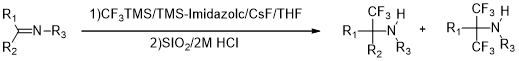
图9 亚胺三氟甲基化反应
Rajendra等[17]用Ruppert试剂作为氟烷基化试剂,用于α-羟基-α-三氟甲基酰胺的制备,是一种类似于生物体内反-雄性激素的化合物,同时是一种前列腺癌的治疗药物。室温下,在反应瓶中加入溶剂四氢呋喃,然后加入反应底物α-酮酰胺,最后加入催化剂TBAF,对α-酮酰胺的氟烷基化进行催化。
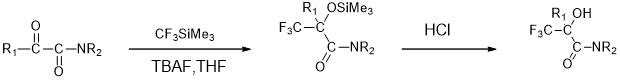
图10 α-酮酰胺三氟甲基化
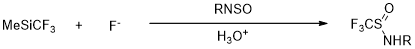
Yagupolskii等[18,19]将Ruppert试剂作为氟烷基化试剂,用于全氟烷基次磺酰胺的制备。在-60~-50℃条件下,在反应瓶中加入THF,在N-烷基次磺酰胺与三氟甲基三甲基硅烷混合,并且向其中加入四甲基氟化铵,最后加入质子迁移剂NH4Cl,反应,期间TLC检测反应进度,直至反应完全后,进行提纯,得到N-烷基三氟甲基次磺酰胺,产率在80%-85%。
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: