美法仑-单甲氧基聚乙二醇高分子前药的制备与性能研究毕业论文
2020-02-19 13:40:07
摘 要
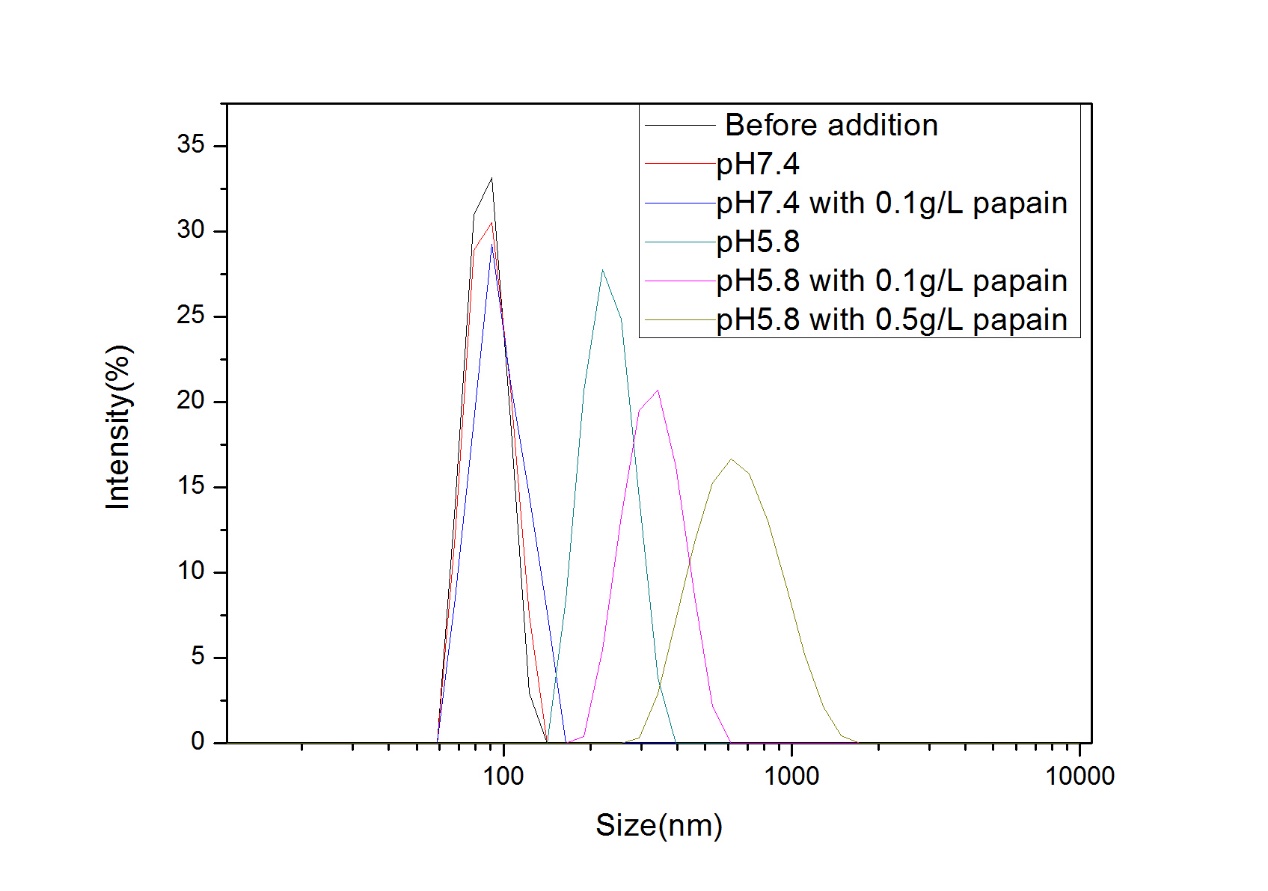
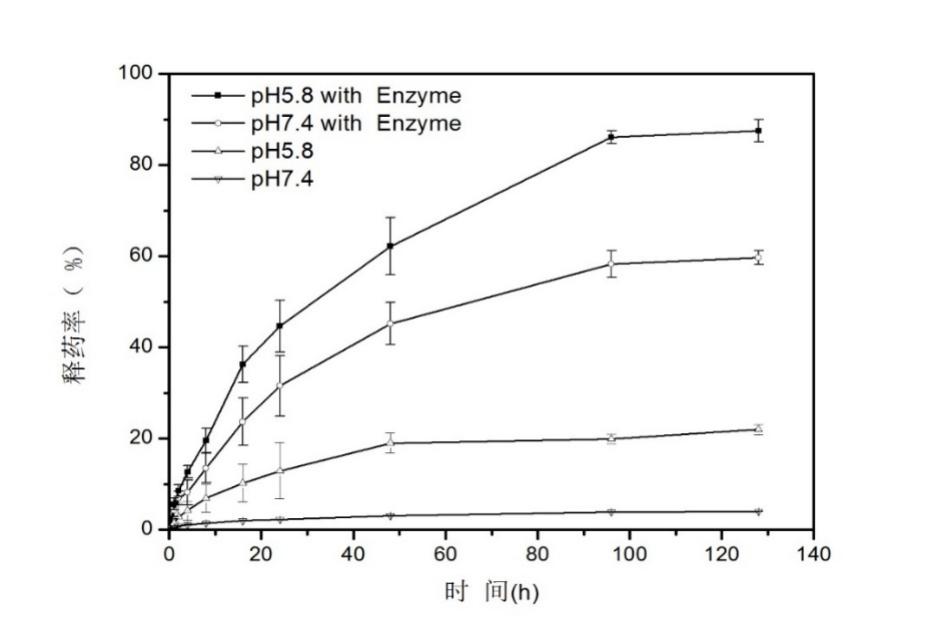
美法仑作为一种抗肿瘤药物,有着很多局限性,如水溶性差、体内半衰期短,为了提高其水溶性以及达到体内缓控释效果,本文通过对氨基苯甲酸酯封端的聚乙二醇单甲醚(mPEG-NH2)重氮化,再对小分子美法仑静电吸附,使用UV引发离子键转化成羧酸酯键获得两亲性缀合物(mPEG-Mel),该缀合物可在去离子水中结果超声自组装制备成一种高分子前药纳米胶束,通过研究该胶束的pH/酶响应性发现,在pH 7.4的缓冲溶液中,此纳米胶束粒径分布均一,集中在130nm,几乎不会释放小分子的美法仑,但当pH 5.8且含0.5mg/ml木瓜蛋白酶的条件下,48h纳米胶束粒径增大到675nm。为探究纳米胶束释药性能,发现在pH 5.8且含0.5mg/ml木瓜蛋白酶的条件下,130h时释放了高达85%的美法仑,是不加酶情况下的5倍,和粒径分布结果一致。实验结果表明,本文所制得的高分子前药胶束具有良好的pH/酶双重响应性,能有效达到缓控释效果。因此pH/酶双重响应性的美法仑-单甲氧基聚乙二醇高分子前药可能在抗癌药物缓控释领域有着很好的前景。
关键词:两亲性高分子前药,静电自组装,美法仑,pH响应性,酶响应性
Abstract
Mephalan, as an anti-cancer drug, has many limitations. In order to improve its water solubility and achieve sustained and controlled release in vivo, the amphiphilic conjugate (mPEG-Mel) was obtained by diazotization of polyethylene glycol monomethyl ether (mPEG-NH2) capped by aminobenzoate, electrostatic adsorption of small molecule Mephalan, and conversion of ion bond initiated by UV into carboxylate bond. The nanomicelles were prepared by ultrasonic self-assembly in deionized water. The pH/enzyme responsiveness of the nanomicelles was studied. It was found that the size distribution of the nanomicelles was uniform in buffer solution with pH 7.4. The nanomicelles were concentrated at 90 nm, and almost no small molecule was released. However, when pH 5.8, the size distribution of the nanomicelles was dispersed, indicating that the nanomicelles were released. In the presence of 0.5 mg/ml papain, 85% of Mephalan was released at 130 h, five times as much as that without enzyme. The results of particle size distribution also indicated that Mephalan was successfully released. The experimental results show that the prepared polymer prodrug micelles have good pH/enzyme dual responsiveness and can effectively achieve sustained and controlled release effect. Therefore, the pH/enzyme dual-responsiveness of Mephalan -monomethoxy polyethylene glycol polymer prodrug may have a good prospect in the field of sustained and controlled release of anticancer drugs.
Key words:Amphiphilic polymer prodrug, electrostatic self-assembly, Melphalan, pH response, enzyme response
目录
中文摘要 3
Abstract 4
第1章 绪论 6
1.1纳米药物传递系统的概述 6
1.1.1纳米药物传递系统的概念 6
1.1.2纳米药物运释系统的优点 8
1.1.3纳米药物传递系统的研究进展 8
1.1.4纳米药物运释系统在肿瘤治疗中的应用 8
1.2两亲性高分子前药的概述 9
1.2.2高分子前药的概念 9
1.2.2高分子前药的分类 9
1.2.3高分子前药的释药机制 10
1.2.4两亲性高分子前药的概述 10
1.3美法仑的概述 11
1.4 mPEG的概述 12
1.5重氮盐静电自组装技术的概述 12
1.5.1对氨基苯甲酸的概述 12
1.5.2静电自组装技术的概述 12
1.5.3.重氮盐静电自组装技术的概述 13
1.6.本文的主要内容和基本思想 14
第2章pH/酶响应美法仑-单甲氧基聚乙二醇高分子前药的制备及研究 15
2.1引言 15
2.2实验部分 15
2.2.1实验试剂及仪器 15
2.2.2实验方法及步骤 17
2.3结果与讨论 18
2.3.1.mPEG-Mel胶束的制备 18
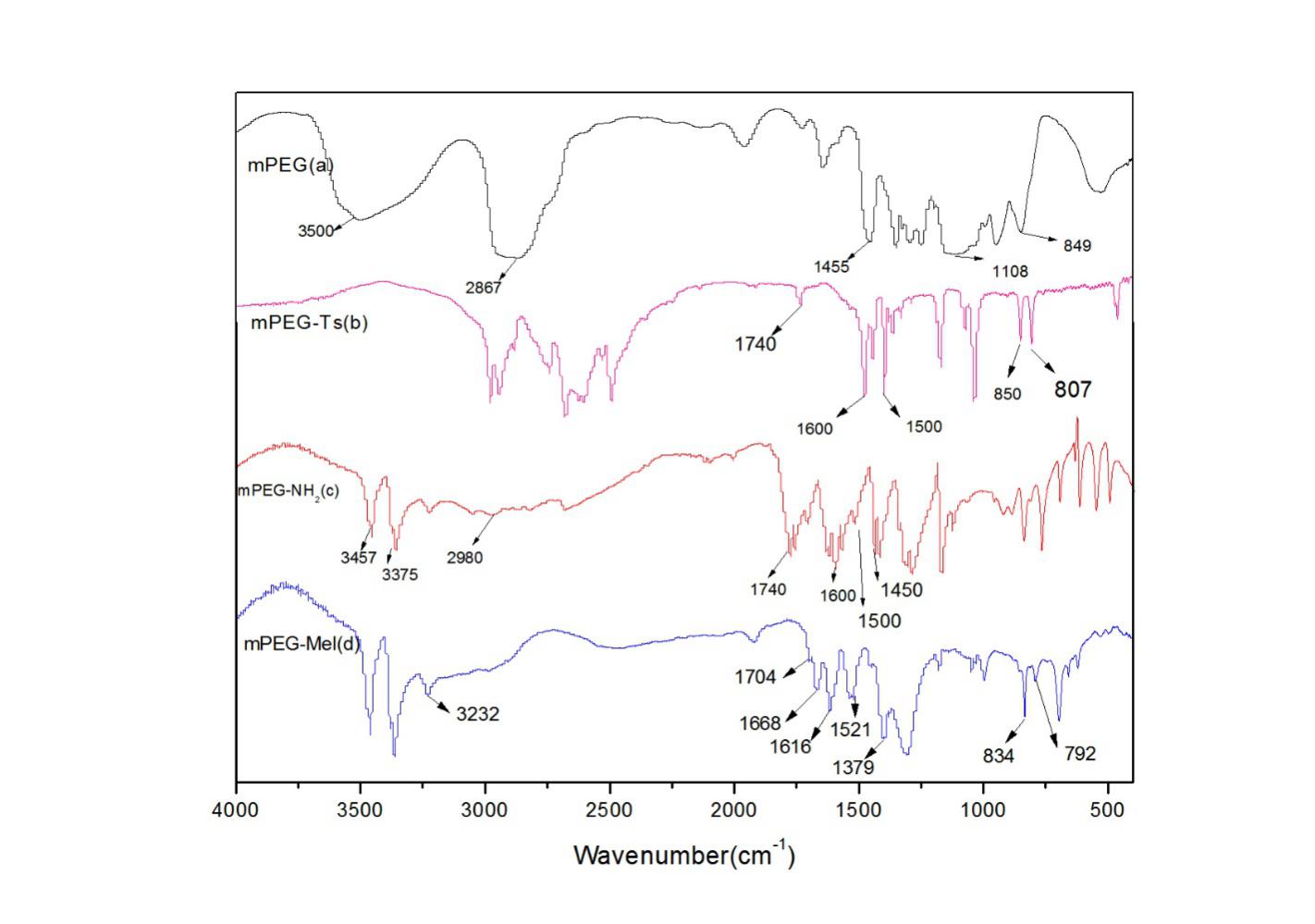
2.3.2红外光谱表征 19
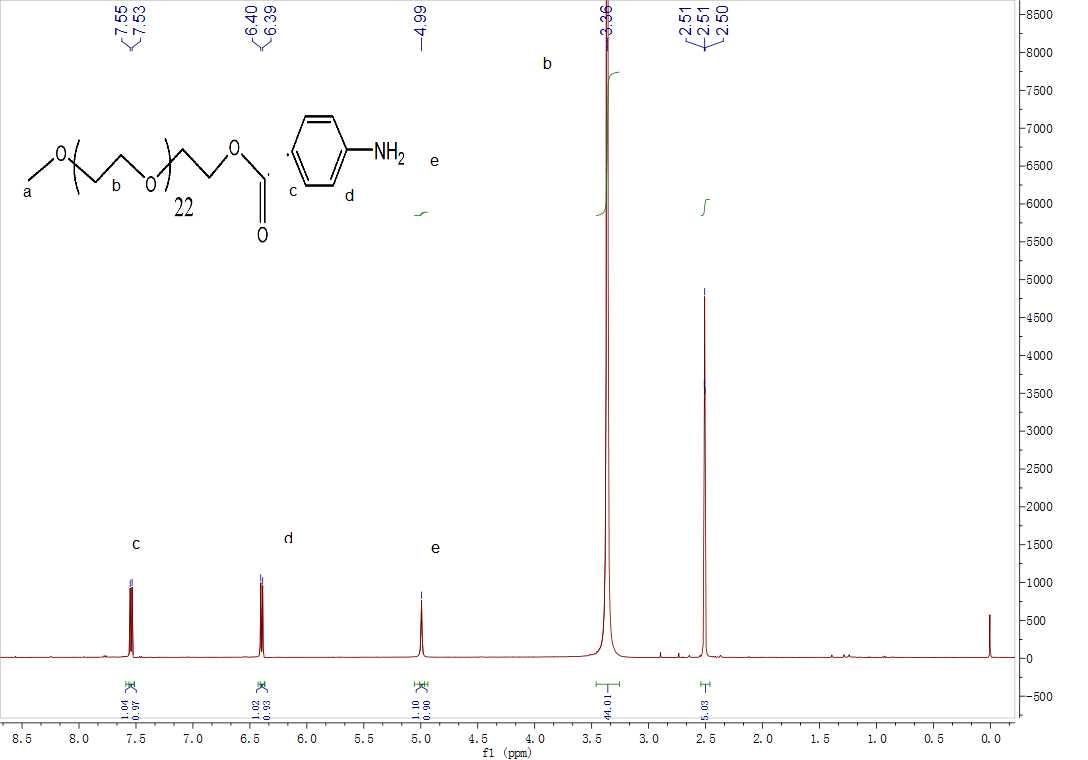
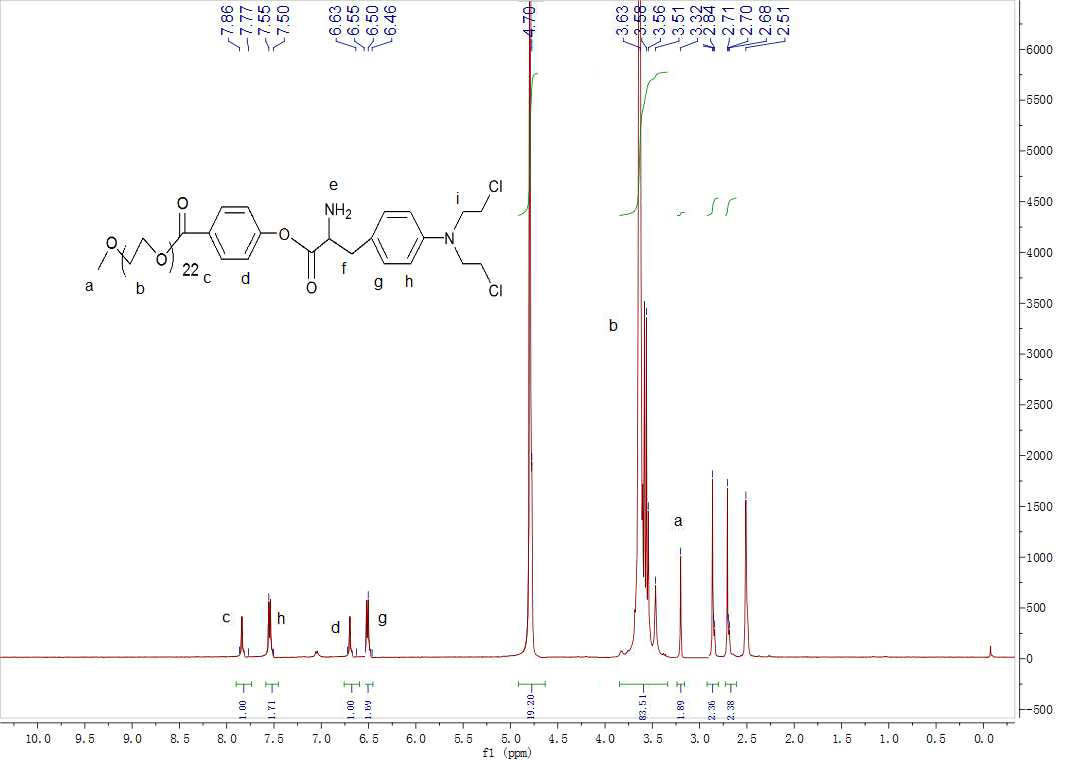
2.3.3核磁分析 20
2.3.4 pH/酶响应性粒径分析 21
2.3.5体外释药分析 22
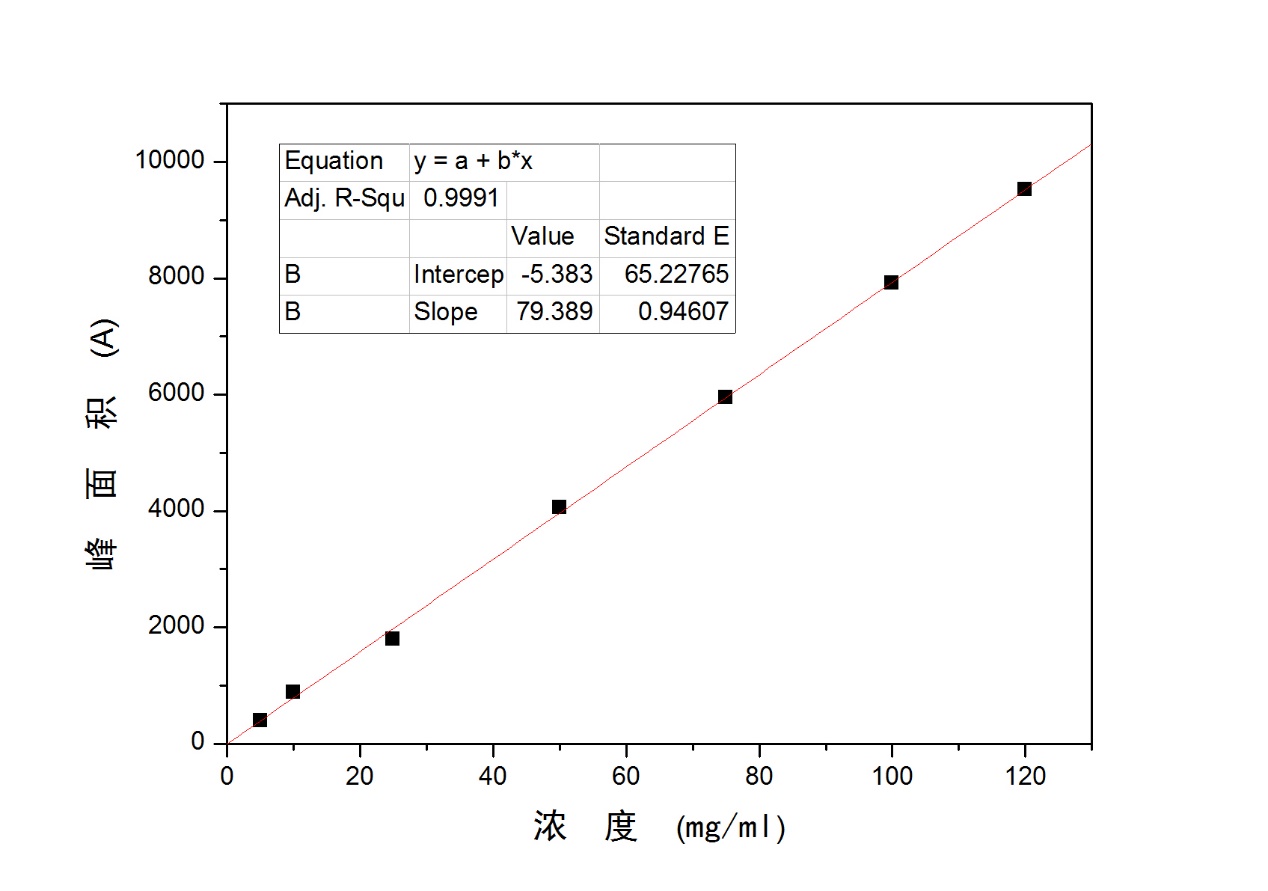
2.3.6 Mel的百分含量计算 23
第3章 结论 24
参考文献 25
致谢 27
第1章 绪论
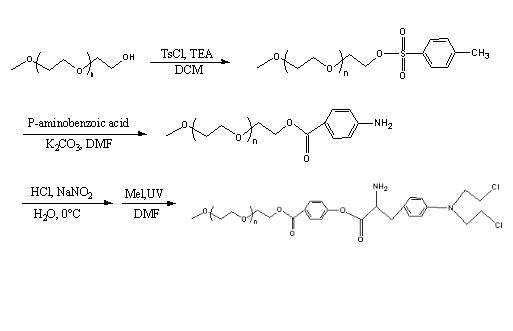
尽管美法仑(Melphalan)作为FDA认可的烷化剂已广泛应用于临床,但由于其特殊的结构,它可以进入癌细胞并发挥作用,导致细胞死亡[1],在大多数肿瘤中起到治疗作用。主要用于治疗多发性骨髓瘤[2]和晚期卵巢癌,特别是晚期乳腺癌,Mel有很好的疗效[3]。然而,与其它烷基化剂一样,Mel在水溶液中无法稳定存在,趋向于自发水解成不具有活性的中间产物[4]。Mel溶液的稳定性受温度、Cl- 浓度和蛋白质含量的影响。美法仑溶液在37摄氏度生理缓冲液中的半衰期约为1.5小时[5]。因此,由于其稳定性差,Mel注射剂是暂时使用的,使用之前必须新制,溶解半小时后迅速注入人体。Mel注射后血药浓度呈指数快速减少,半衰期仅为75分钟。Mel的临床上的应用剂型分为片剂和注射用粉针剂。Mel注射液有许多缺点:使用不便,稀释后的Mel需要振动至少10分钟,才能完全溶解中;它们的稳定性较差。Mel在稀释液中特别不稳定,必须在配置开始后一小时内完成使用[6];生物相容性差,混合液注射对人体特殊部位有强烈刺激性,可使注射部位细胞完全破裂。而Mel片剂在临床运用时首要的缺点有:首关效应(First Pass Effect)使部分Mel代谢为不具有活性的代谢物;药物的吸收不稳定也不完全;生物利用度(bioavailability)非常低等[7]。这几年来,很多学者开始研究由重氮盐介导的静电自组装技术。用对氨基苯甲酸和其衍生物制备成重氮盐,拥有着方法简单、反应过程迅速、高效的优点,最受研究者重视的是这种重氮盐还具有优良的光敏性,目前该技术方案已被普遍应用物理化学、生物材料等多种领域的表面改性。制得的重氮盐在静电自组装中作为阳离子,与溶液中的具有阴离子的小分子首先通过静电力相互吸引,然后由于重氮盐具有的良好的光敏性,通过紫外光辐射使离子键转变为共价键,从而温和、高效地制备两亲性缀合物[8]。
因此,基于上述静电自组装技术,以mPEG为载体,对氨基苯甲酸衍生物为连接基团,美法仑为活性抗癌药物,制备一种大分子前药,以解决上述所有的问题。
1.1纳米药物传递系统的概述
1.1.1纳米药物传递系统的概念
药物传递系统[9,10](DDS)的概念最早出现在1970年代。通常是指运用现代制剂技术和高分子材料或聚合物[11]等,将小分子药物分散于结构复杂、特殊而巧妙的体系中,从而达到按照预期方式、速率释放药物并将其运输至靶位的目的。DDS的最终目标是将药剂的使用量和服用量减少到最小限度,从而达到最佳的治疗效果。药物传递系统一般包括两方面[12]:一是根据病情的变化,最大限度地减少药物配送量,减少药物服用量,减少药物配送量,减少药物对正常组织的损害[13]。药物配送系统最大的优点是药物制剂的特异靶向性和药物释放控制性的有效组合。自二十世纪八十年代以来,药物传递系统成为最火热的研究项目之一[14]。
纳米技术的出现和快速的发展带来了将二者结合的机会。迄今为止,关于纳米粒子药物传递的研究,是一个非常抢手的研究课题。传统上,纳米药品递送系统指用天然或合成高分子材料封装的纳米粒子分散药品递送系统。该固体胶质载波的粒径通常为10~1000纳米,主要是100~500纳米。纳米粒子可以根据如图1.1所示的结构分为纳米球和纳米囊[15,16]。
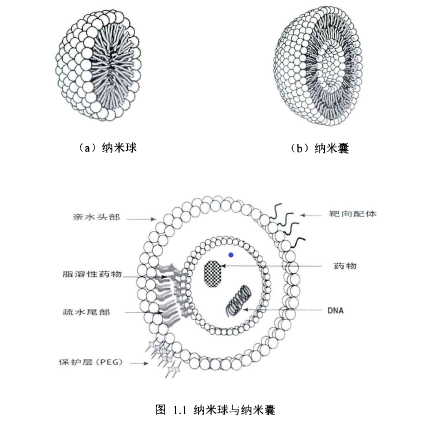
纳米球大部分是通过简单吸附,或共价耦合吸附在纳米球的表面的骨架型结构分子,也有的被嵌入表面层和空隙中,还有的一些完全封入纳米球体;纳米囊作为载体时,亲脂性药物可以被插入类脂体壳中,亲水性药物可以进入核心,或者可以被吸附到表面。
理想的纳米粒子载体必须是高度的药物负荷和胶囊化效率,比较长时间的的体内长循环、适当的粒子尺寸及形状、可生物分解的材质、无毒性或毒性少的纳米粒子载体。
目前,纳米药品传递系统作为载体的效果远远高于传统药物传递系统。近这几年来,对温度、pH、光、磁场、酵素敏感的新型的智能纳米药物传递系统材料在各种药物的缓控释领域有着非常好的应用前景[17]。
1.1.2纳米药物运释系统的优点
近年来,与传统药物载体相比,纳米粒子作为药物载体具有以下巨大优势:
靶向性:在进入人体后,纳米颗粒主要被识别为外来物体,然后被巨噬细胞所吞噬,直到达到肝脏、骨髓、淋巴结和其他特异性组织的靶位。特异性结合后,它们可以实现活性靶向目标,选择性地杀死癌细胞,并大大减少正常细胞的死亡。
提升药物的稳定性:纳米粒子能对应地提高一些容易被体内环境分解失活破坏的药物的稳定性,此外纳米颗粒的封装如纳米球、纳米囊等可防止药物在人体长循环递送过程中太早地失去应有的活性。
长期缓释并增加药效时间:由于纳米颗粒能吸附和包封药物,起到保护作用。因此,纳米颗粒可以降低药物在体内的清除率,增加药物的作用时长,使靶区药物浓度增加。通过调节载体材料中纳米颗粒和药物的比例,可以改变药物释放速率。
药物生物利用度的提高:载药纳米粒由于靶向性和缓释性,可以大大提高药物的生物利用度,减少对正常组织的毒性和副作用。
1.1.3纳米药物传递系统的研究进展
纳米药物传递系统近年来可以使用在各种药物传递和剂型改良中。在各种疑难重症中都有很多应用研究,如抗肿瘤、糖尿病治疗、抗艾滋病或者作为疫苗佐剂等等。
近年来很多学者发现,将抗艾滋病的药物用纳米球或纳米囊装载后,可显著改善艾滋病疗效。Wissing[18]等人研究表明,将叠氮胸昔使用纳米粒子装载后,通过注射剂的方式,对小鼠进行静脉注射的方式使叠氮胸苷进入到其体内,可使小鼠体内单核巨噬细胞内的叠氮胸苷的浓度极大地增加。
1.1.4纳米药物运释系统在肿瘤治疗中的应用
目前,恶性肿瘤的治疗方法很多。化疗是目前大众治疗恶性肿瘤最普遍也是最基本的方法。指一种或多种经口注射或服用以治疗肿瘤的化疗药物。但是,目前的化疗方法有两个非常大的缺点:化疗药物在肿瘤治疗过程中对正常人体组织的严重毒性和副作用;以及诱导癌细胞抵抗,特别是多药耐药的易感性。所以,寻找各种低细胞毒性、高疗效、靶向杀伤肿瘤细胞的新型抗肿瘤药物已成为癌症治疗领域的头号难题。纳米药物传递系统利用癌细胞的强吞噬能力和癌组织血管的高渗透性和滞留效应(EPR),使静脉注射纳米颗粒能有效地转移到病变部位,大大提高疗效[19]。
1.2两亲性高分子前药的概述
1.2.2高分子前药的概念
高分子前药的概念最初是由德国的林格斯多夫于1975年提出的,它指的是通过物理或化学方法将药物(活性小分子)和高分子化合物结合起来形成高分子,高分子前药的载体部分就是各种高分子化合物,也称为Polymer Prodrug,是一种具有特殊形式的能够搭载在高分子上的药物。。小型分子药物往往有许多在临床上无法顺利使用的瓶颈,小型分子药物的溶解度、稳定性和药理学特性可以通过高分子载体的搭载而得到改善,具有持久释放特性和长期的作用效果。考虑到被动定向和特定分布的特点,高分子前药可以改善药物的使用,减少药物的毒性和副作用.具有不同结构和特性的Polymer Prodrug可以通过选择不同的高分子载体和小分子药物组合来制得。因此,可以通过高分子载体和小分子药物的设计来改善药物的体内释放,改进定向性和靶向性,提高药物的有效性,而一种临床上理想高分子前药主要由靶向基团、生物活性成分(小分子)、高分子链、间隔基组成[20],如图1.2所示。
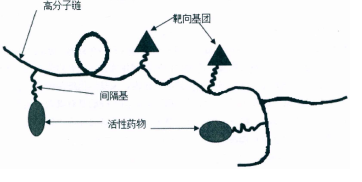
图1.2高分子前药结构示意图
1.2.2高分子前药的分类
在高分子前药研究领域,目前的研究者依据高分子的来源,可将所有高分子前药分为天然材料高分子前药和合成材料高分子前药。一般地来说,天然高分子前药的体内生物活性会比合成高分子前药的高[21]。
合成高分子前药中比较常用的主要有:聚乙二醇、聚氨基酸类、聚N-(2-羟丙基)甲基丙烯酰胺、聚乙烯基吡咯烷酮等。
天然高分子前药种类较少,主要有:葡聚糖、壳聚糖等。
本文实验部分采用聚乙二醇单甲醚(mPEG)。
1.2.3高分子前药的释药机制
这些高分子前药的生物活性在没有被循环运送到目标区域之前是非常低甚至完全没有的,只有通过体内循环时达到预定的目标(靶位)后,和体内的特异性配体结合,并被特殊的、具体的刺激后,如经过酶反应或者水解后,被特异性激活,然后释放小分子药物,最后就可以发挥小分子药物的作用完成治疗效果,激活过程可以只发生在人体的各种具体的目标,如肝脏、肾脏、脾脏或其他特殊的组织或特殊的细胞。根据高分子载体与小分子药物在体内的分离机制能够将所有的体内作用方式分为这几类[22]:酶响应,水解响应,pH响应,或通过间隔基的还原响应。
1.2.4两亲性高分子前药的概述
两亲性高分子前药是由亲水性和疏水性片段组成的大分子,它们彼此之间不可溶,并且暴露在微分离的两亲性聚合物中,这使得它们具有非常显著的优势,并被广泛应用于诸如改进药物疗效,部分溶解等项目。然而对研究人员来说更为重要的是,两亲性聚合物具有较强的自组织能力,也就是说它们可以自发地形成序列,这让它们在生物载体,纳米囊等研究领域有着非常好的实施方案和研究进展。正式因为这一特点,两亲性高分子前药能够解决目前普通前药面临的瓶颈,两亲性嵌段的两端可以分别与另外的两亲性嵌段相连,这些嵌段可以在溶剂中自组装成为高分子纳米粒子,比如谢志刚[23]等人近来制备了一种高分子前药,他们发现这种在水中能自组装成为纳米胶束的mPEG-PLA/DX,这种纳米高分子载药系统释放的DX与纯的DX有着相似的药物活性,并且高分子载药系统释放的DX能够缓释长效作用。
由于纳米颗粒相对粒子大小比较小,而比表面积大,所以相比于其他载体,纳米颗粒的药物负荷量很高,而且能够通过其特殊的纳米结构,在特定的靶位聚集,比如Blanco[24]等人通过实验制备了,聚乙二醇—聚乳酸胶束来搭载一种抗癌药物,通过分析发现,该胶束能稳定存在,而且有着长时间不降低的血药浓度,在肿瘤细胞中通过EPR效应能够迅速膨胀式聚集,保留时间很长。史杨[25]等人通过将单甲氧基聚乙二醇与聚甲基丙烯酰胺进行静电自组装,生成了体外释药非常稳定的mPEG-b-p(HPMAm-Bz)纳米胶束,该胶束能够负荷大量的紫杉醇,有着很好的保留时间,使得在目标靶位大量积累,能够大大提高紫杉醇的药效,并通过细胞实验证明,这种载药高分子胶束的耐受性较好,细胞毒性也不高,有着更加优良的生物相容性。
1.3美法仑的概述
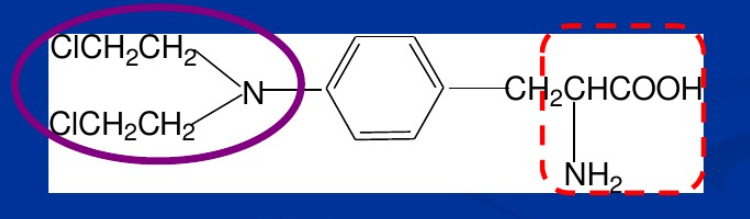
美法仑是左旋苯丙氨酸氮芥,氨基酸类氮芥,对多种恶性肿瘤均有疗效,其作为一种烷化剂,由于其结构的特异性,使其可以进入肿瘤细胞内而发生作用,当载体部分位肿瘤细胞生长所需的苯丙氨酸时,能够提高抗肿瘤作用的选择性,使药物能够浓集于肿瘤组织,导致细胞死亡,从而起到抗肿瘤的作用,美法仑在临床上主要被用于治疗多卵巢癌、乳腺癌、淋巴肉瘤和多发性骨髓瘤等,而且对于晚期的恶性乳腺癌有着非常好的效果,但作为氮芥类抗癌药,美法仑与其他脂肪氮芥、芳香氮芥、杂环氮芥、甾体氮芥等一样,有着很多缺点,比如毒副作用大,选择性靶向性不高等。虽然美法仑经FDA认可已经广泛用于临床,但是美法仑在水溶液中稳定性不高,一般都能在人体内能够自发水解,产生不具有活性的中间产物。美法仑溶液的稳定性受温度、氯离子浓度和蛋白质含量等因素的影响。所以就因为其稳定性很差,美法仑的注射剂常常在使用之前临时新制,然后在特殊溶剂中溶解半个小时之后再迅速注入人体内,血药浓度呈指数形式快速减少,清除的半衰期仅有75分钟。图1.3是美法仑的结构示意图。
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: