肿瘤靶向MOF材料UIO-66-N3的合成与表征毕业论文
2020-02-19 13:40:17
摘 要
本课题旨在设计一种集靶向和诊疗于一体的多功能的肿瘤靶向纳米递释载体。
在本课题中,我们选择含Zr的UiO-66为模板材料,在相对较低的温度条件下采用溶剂热法,将反应物二价锆(Zr)和BDC-N3溶于较高沸点的极性溶剂(DMF)中,搅拌混合均匀后,通过金属盐与有机配体在耐压管中的自组装反应,合成叠氮化修饰的UiO-66-N3纳米粒。再将广谱抗癌药DOX通过物理吸附的方式载药到UiO-66-N3的孔隙中。通过点击化学反应,将甲氧基-PEG-丙炔和MAL-PEG-丙炔修饰在UiO-66-N3的表面。然后采用F3多肽作为靶向配体,将其修饰在UiO-66-N3的表面使纳米粒具有主动靶向性,从而合成DOX/UiO-66-PEG-F3纳米载药体系,并同时进行FT-IR, 1H-NMR, TEM, DLS,VIS-UV等的表征实验和体外释放实验。
根据表征结果,多功能纳米载药平台DOX/UiO-66-PEG-F3已被成功合成,其具有合适的粒径大小和分散度,在表面修饰和靶向配体加载的过程中,UiO-66的结构保持了很好的结构完整性,具有被动靶向的基础。体外释放特性的研究,证实了我们所合成的产物具有较好的pH敏感性释放药物的能力,为MOFs在肿瘤治疗中的应用,提供了一定的理论与实践基础。
关键词:纳米有机金属框架材料;纳米载体;靶向;体外释放
Abstract
The purpose of this topic is to design a multifunctional tumor targeting nanodelivery carriers which integrates targeting and treatment.
In this topic, we chose UiO-66 with Zr as model material. At relatively low temperatures, we adopted solvothermal method to dissolve the reactant zirconium (Zr) and BDC-N3 into the polar solvents (DMF) with higher boiling point, and mixed them evenly. After this step, we synthesized the azidated modified UiO-66-N3 nanoparticles through the self-assembly reaction of metal salts and organic ligands in pressure pipes. And then, we loaded the broad-spectrum anticancer drug DOX into the hole of UiO-66-N3 through physical adsorption. Through clicking on chemical reactions, we modified the methoxy-PEG-propyne and MAL-PEG-propyne on the surface of UiO-66-N3. And then, we adopted F3 polypeptide as targeting ligand and modified it on the surface of UiO-66-N3 to make the nanoparticles have initiative targeting ability. So then, the DOX/UiO-66-PEG-F3 nanoparticle drug delivery system was composed, and at the same time, we did the characterization experiments and in vitro release experiments on FT-IR, 1H-NMR, TEM, DLS and VIS-UV.
According to the results of characterization experiments, multifunctional anoparticle drug delivery system DOX/UiO-66-PEG-F3 has been composed successfully. It has suitable particle size and dispersion. In the process of modifying the surface and the loading of targeting ligand, the structure of UiO-66 kept good completeness and it had the basis for passive targeting. The research on in vitro release characteristics confirmed that the products we composed had better pH-sensitive drug release ability. It provided a certain theoretical and practical basis for the application of MOFs in cancer treatment.
Key words: nanoorganic metal framework materials;nanocarriers,;targeting; in vitro release
目 录
第1章 绪论 1
1.1研究背景 1
1.2研究的目的、意义 1
1.3纳米有机金属框架材料概述 2
1.4 UiO-66概述 3
1.5 国内外研究现状 3
1.6 研究目标及内容 4
1.6.1研究目标 4
1.6.2研究内容 4
第2章MOF材料UiO-66-N3的合成与表征 6
2.1引言 6
2.2 实验部分 7
2.2.1 实验仪器和材料 7
2.2.2 DOX/UiO-66-PEG-F3纳米载体的合成 8
2.3 实验结果与分析 11
2.3.1 测试与表征 11
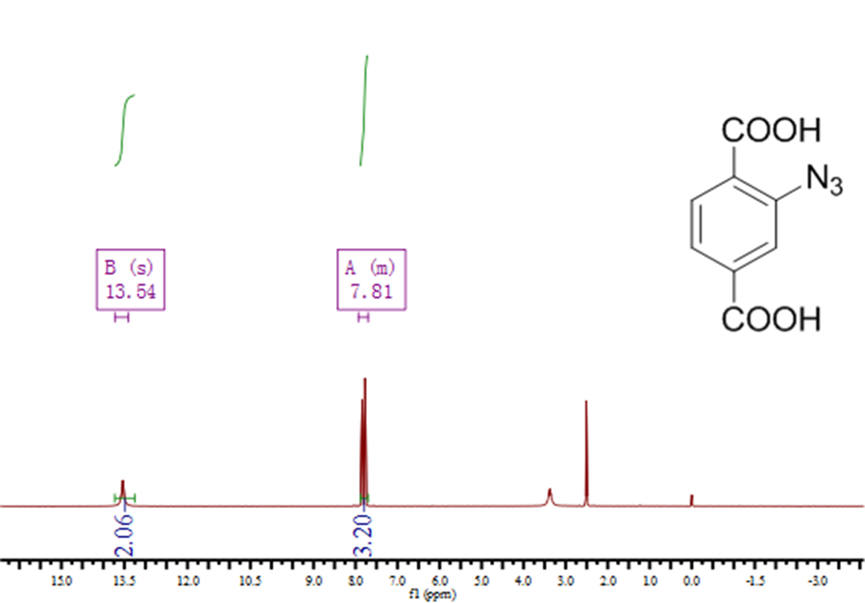
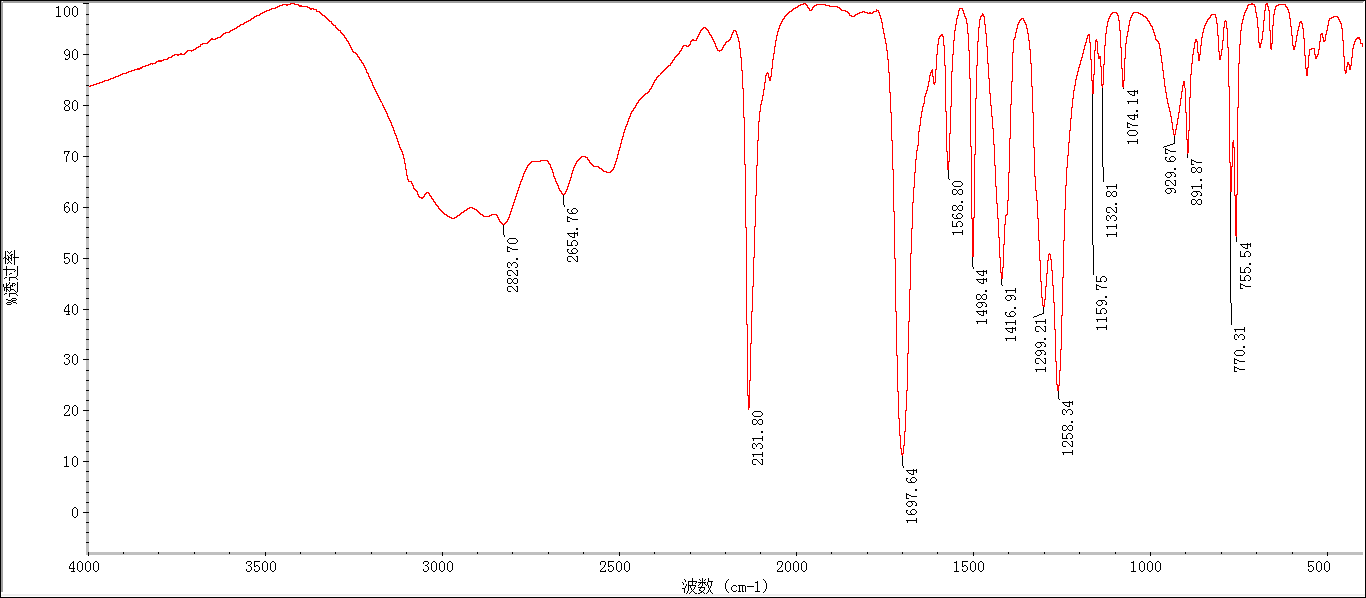
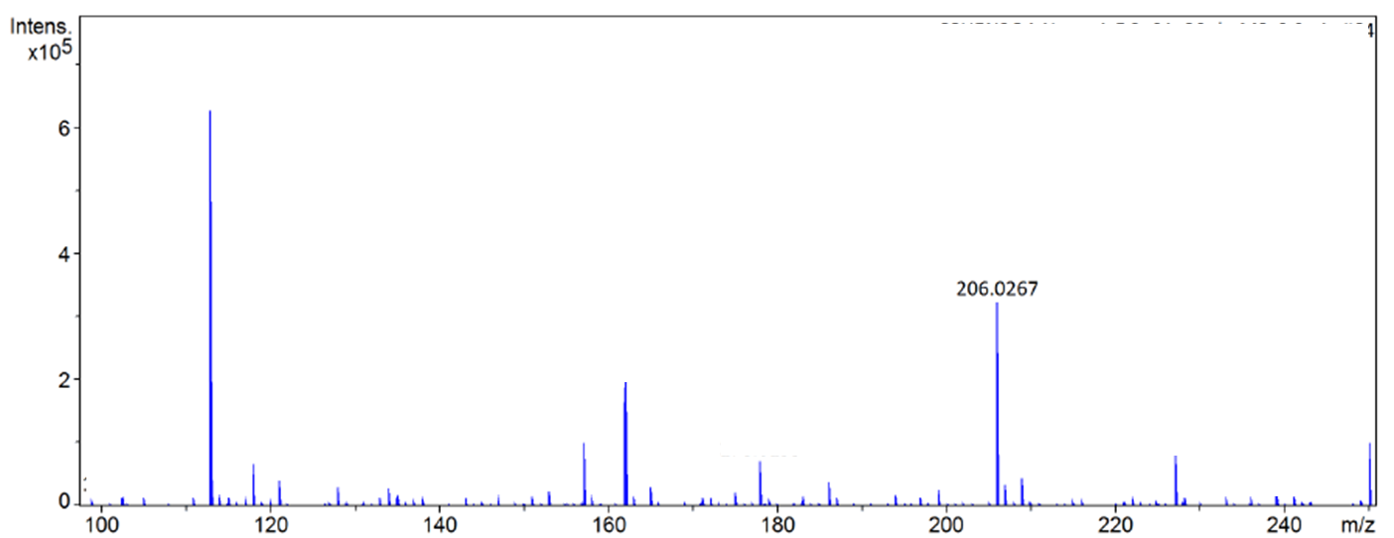
2.3.2 BDC-N3的表征分析 11
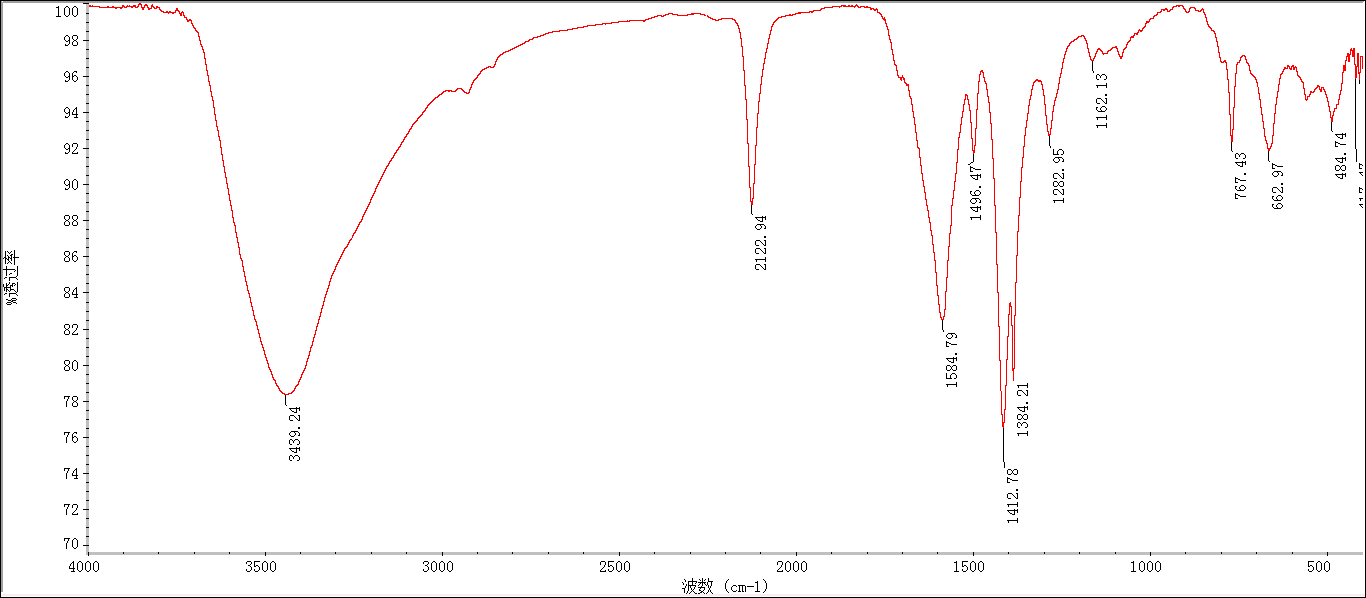
2.3.3 UiO-66-N3的表征分析 13
2.3.4 UiO-66-PEG的表征 13
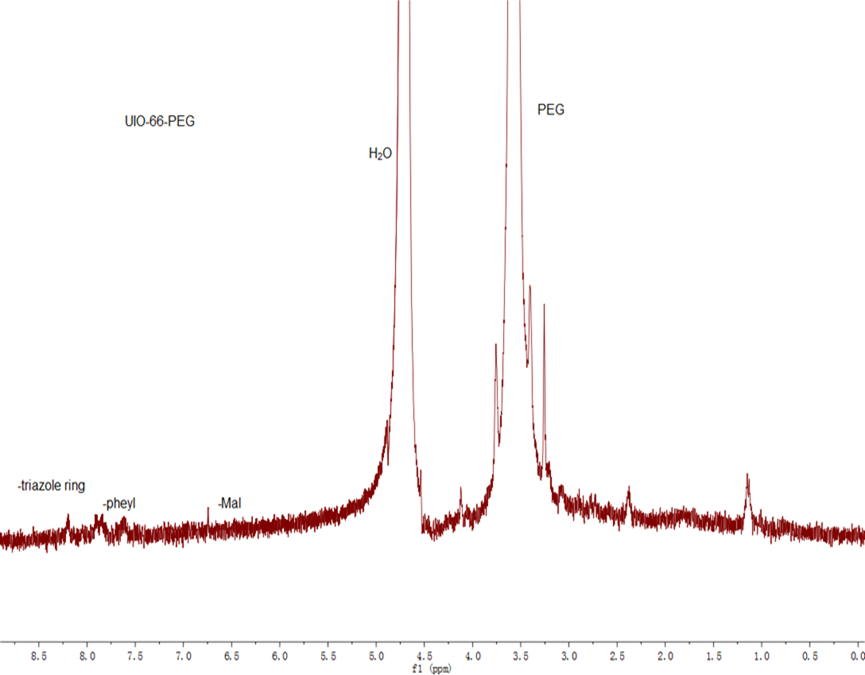
2.3.5 纳米载体DOX/UiO-66-PEG-F3的表征 15
2.3.6 纳米载体UiO-66缀合物的表面电势表征 16
2.3.7 UiO-66缀合物的粉末X射线衍射(PXRD)表征 16
2.4 UiO-66缀合物的粒径大小和形态的表征 17
2.4.1 透射电子显微镜下的形态观察 17
图2-15 透射电子显微镜 18
2.4.2 纳米载体UiO-66缀合物的粒径 18
2.5纳米载体UiO-66缀合物的体外释放研究 18
2.5.1 DOX标准曲线的绘制 18
2.5.2 体外释放速率 19
2.6结果与讨论 20
第3章 总结 22
致 谢 23
参考文献 24
第1章 绪论
1.1研究背景
在当前对肿瘤治疗的研究中,化疗是运用比较广泛的一种方案,由于化疗经过了一个多世纪的快速发展,目前针对各类肿瘤治疗已经有了大量比较成熟可靠的化疗方案。然而,化疗也有自身的局限性,在治疗过程中通过直接将药物引入血液中,它们也会直接地伤害到健康细胞,并会引起严重的并发症,如感染,脱发、恶心等。因此,在实际治疗中,化疗疗程通常需要有戒断期,以帮助患者恢复化疗带给正常细胞的损伤。但是,这反过来又会导致疾病复发的高风险,快速新陈代谢的问题也会降低药效。这些条件使得病变位置的精确定位成为当前研究中的热点。
目前,利用纳米材料进行药物传递,并靶向识别恶性肿瘤组织,是一个比较热门的方向。随着纳米技术的快速发展,可以使用制备简单,廉价、毒性较低且具有特殊物理化学性质和生物学功能的的纳米材料来治疗肿瘤疾病。近年来,纳米技术领域不断取得突破,为多功能药物载体纳米材料的创造奠定了新的基础。这些纳米级骨架材料在药物输送系统的设计中带来无限的可能性。
1.2研究的目的、意义
从目前的研究结果来看,虽然癌症的早期诊断和治疗长期以来一直是医学界的一个难题,如何更准确地诊断和治疗癌症更是科研人员研究的目标。纳米技术的快速发展或许可以提供一个新的思路与方向,利用其独特的理化特性,结合电学,光学,磁学和其他相关学科,可以实现肿瘤组织和细胞的标记,成像和靶向治疗。同时,将纳米材料制备成具有靶向性的药物递送系统,可以用于肿瘤的组合疗法。
生物相容性、药物有效载荷和控制释放功能是理想的药物输送系统(DDS)所必须满足的要求。为了避免载体材料与抗肿瘤药物反应对人体器官造成损害,所以载体材料本身应具有化学和生物学惰性。理想的药物输送系统的关键因素是有效载荷能力,因此输送剂量应该被精确控制,剂量过大或过小对于疾病的治疗都是不利的。
基于纳米粒子的优点,当前已开发出了许多用于生物医学应用的药物递送系统,包括碳纳米管,聚合物纳米粒子,金纳米粒子和介孔二氧化硅纳米粒子。但是,这些纳米材料也有其自身的局限性,例如有机平台表现出对药物释放的控制不足,无机平台的低负荷效率和生物相容性往往不能满足治疗需求。更好的药物输送系统(DDS)结合良好的生物相容性和精确的药物输送等特征仍需要我们去关注和进一步开发。
1.3纳米有机金属框架材料概述
在本课题中,基于前述原因,我们把目光转向当下比较热门的的纳米金属-有机骨架(nMOFs)。这是通过配位键将金属盐和有机配体彼此连接而形成的多孔无机-有机杂化材料。由于 MOFs的孔道常可在脱除其客体溶剂分子后保持稳定,在 MOFs材料的研究初期,研究重点集中在气体吸附和分子自组装过程的研究上;随着对MOFs研究的深入,研究重点逐渐从气体吸附扩展到磁性,光学,分离科学,催化和药物输送等热门研究领域。[[1]]目前,载药量低是制约药物传递系统发展的主要因素,而纳米金属-有机骨架由于具有多孔性,其内部具有亲水亲油基团,从而可以打破载药量低的桎梏,实现较高的载药量。此外,MOFs种类具有多样性,可以选择不同的金属离子与各种有机配体进行络合。可根据药物的性质,设计出具有不同孔道结构和化学特性的金属-有机骨架。这种材料与其他载体相比,除具有载药量高外,还具有种类多样性、结构可设计性与可调控性等优点。[[2]]这些优点使MOFs成为治疗癌症的通用平台,在药物传递系统中的运用发展前景广阔。
据报道,近年来有大量关于癌症治疗的研究涉及使用nMOF材料,例如基于铪-二氢卟酚的nMOF具有良好的结肠癌光动力治疗(PDT)功效。最近,铪-四(4-羧基苯基)卟啉基的nMOF被聚乙二醇化并成功地用于组合的PDT和辐射小鼠乳腺癌模型中的治疗。目前已经出现了多种有效的治疗组合,例如小干扰 RNA(siRNA)/化学药物,几种双重化疗药物(如吉西他滨和奥沙利铂),或化疗药物/ PDT,已经尝试在体内治疗肿瘤并且已经获得了令人鼓舞的数据。另一方面,尽管已经收集到令人信服的证据来证明 nMOF可以容易地用于多个成像技术,如计算机断层扫描(CT),磁共振成像(MRI)或光学成像,然而,使用nMOF作为体内肿瘤成像剂进行的研究,迄今为止仍非常有限。
1.4 UiO-66概述
UiO-66 是 2008 年由挪威奥斯陆大学研究开发的、一种含有 Zr 的金属有机骨架材料[[3]]。
UiO-66具有优异的水热稳定性和化学稳定性,可承受1.0 MPa的机械应力。UiO-66可以在水,DMF(N,N-甲基甲酰胺),苯或丙酮中保持结构稳定性。并且还具有很强的耐酸性和一定的耐碱性。 UiO-66的稳定性如此突出的原因在于,首先,在理想条件下,UiO-66的结构单元通过 “Zr6O4(OH)4” 金属簇与12个H2BDC的配位形成。这是MOF中发现的最丰富的有机配体和金属簇。密集的结构单元使整个结构稳定;其次,Zr具有较高的亲氧性,因此在UiO-66结构中,Zr-O键越强,结构稳定性越好。UiO-66的孔结构由约1.1nm的规则八面体笼和零孔组成。将大约0.8nm的规则四面体笼连接到0.6nm的三角形窗口。虽然UiO-66的理想配体配位数为12,但其实际结构具有一定的配体缺陷,这在其他MOF中并不常见。UiO-66结构配体缺陷的程度直接影响比表面积。配体缺陷可以通过合成条件(例如结晶时间或温度)和通过添加不同类型的调节剂来调节。因此,UiO-66的比表面积通常在600-1600m2 / g的范围内[[4]],这是金属-有机骨架材料中最稳定的材料之一。
1.5 国内外研究现状
化学治疗,称为化疗,旨在防止癌细胞的增殖,浸润,转移和最终杀死癌细胞。在20世纪40年代,氮芥被人们发现其可以引起骨髓抑制,因此它被开始用于治疗白细胞增多症等病症。在接下来的几十年里,化疗迅速发展。化疗已从单一药物发展为联合化疗,成为主流的癌症治疗方案。化学疗法在肿瘤的临床治疗中起着重要作用,但小分子化疗药物往往缺乏肿瘤组织靶向。并且由于其本身的性质,这些药物进入人体后会伤害到健康细胞,并引起严重的并发症,如感染,脱发和恶心等,这些都限制了这些药物的临床使用效果。
近年来,纳米科学的高速发展对医学领域产生了重大影响,纳米医学已经成为了一个重要的研究方向。纳米药物传递系统(NDDS)可有效控制体内化疗过程,增加药物在人体肿瘤组织中的分布和积累。同时增加细胞摄入量,释放药物自身行为,达到降低毒性的作用并提高疗效,开发价值较高。
自发现MOF以来,这种新型的有机-无机混合物材料已经在气体储存,催化,分离,电子和光学应用等领域取得了巨大的突破。相关研究已经表明,MOF表面修饰可以在基于MOF的 DDS中实现按需释药,这一优势使 MOF成为癌症治疗的新思路新方向,其在药物输送系统中的应用前景广阔。
1.6 研究目标及内容
1.6.1研究目标
该项目旨在设计一种多功能肿瘤靶向纳米递释载体,该目标兼具靶向和诊断功能。纳米递释载体可以同时实现分子诊断试剂和抗肿瘤剂的靶向递送,从而同时进行肿瘤诊断和治疗。并将通过系统性的细胞及分子生物学实验考察对构建的纳米体系的肿瘤靶向性和治疗效果,对体系的安全性进行评价,考察所制备的多功能纳米诊疗体系作为一种高效、低毒的纳米载体在肿瘤靶向治疗和肿瘤诊断中的应用前景,为开发用于临床诊断和治疗的多功能肿瘤靶向纳米递释载体提供研究基础。
1.6.2研究内容
从目前的 nMOF库中,选择含锆的 UiO-66作为模板材料,该材料由挪威奥斯陆大学于2008年开发,是一种含有 Zr的金属-有机骨架材料。该材料通过含Zr的规则八面体和12个对苯二甲酸有机配体的配位形成。形成具有八面体中心笼(110nm)和八个四面体角笼(约80nm)的三维骨架。这两种类型的笼子通过三角形窗口(约60nm)连接。它具有良好的热稳定性(超过500℃)[[5]],是金属-有机骨架材料中最稳定的材料之一。
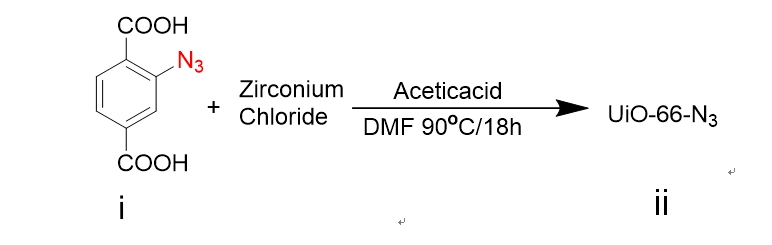
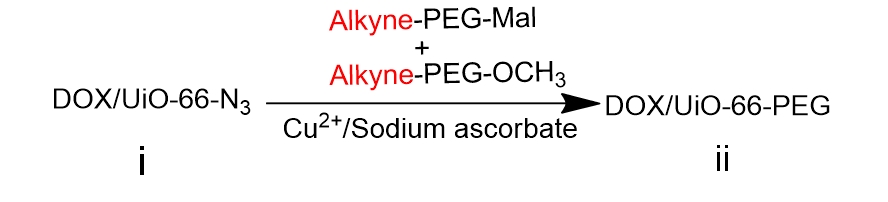
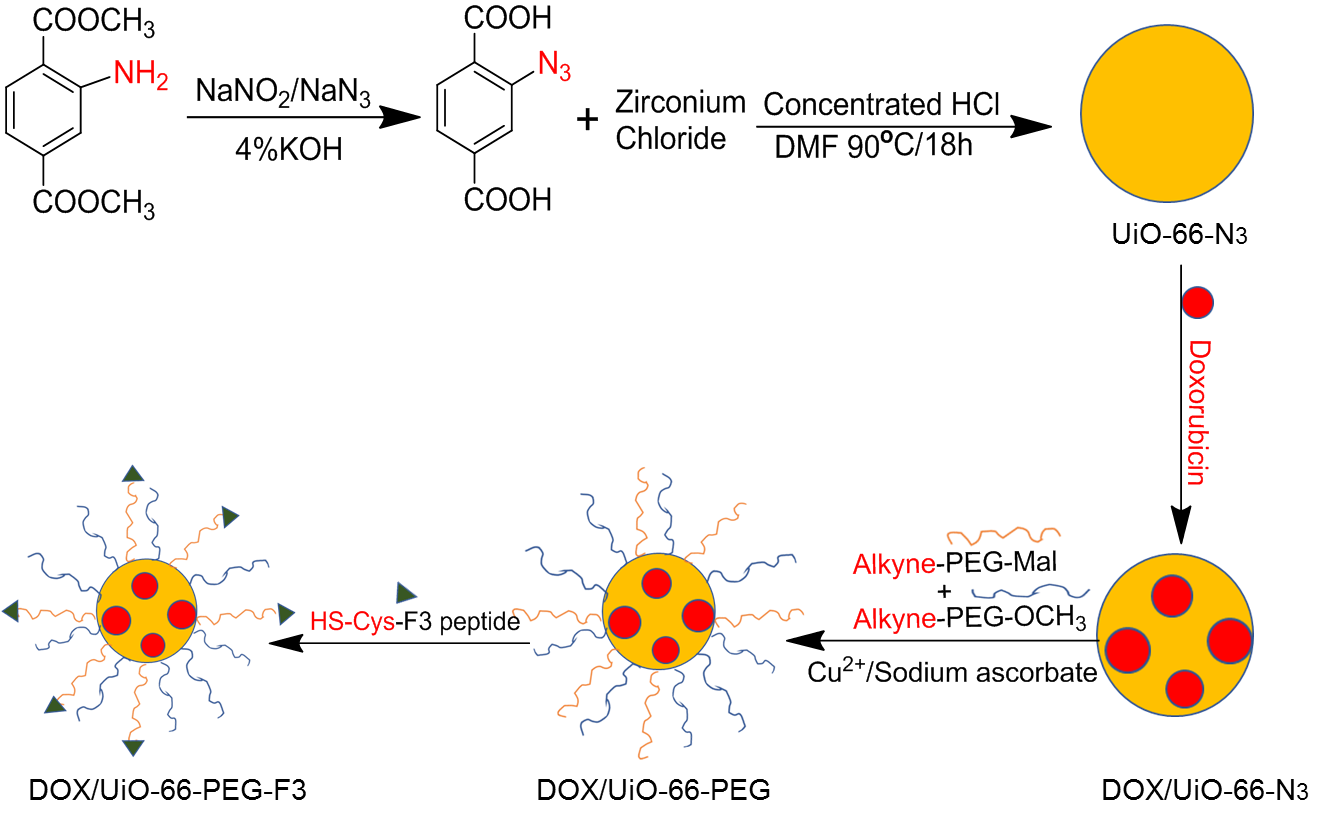
本课题中,我们在相对较低的温度条件下采用溶剂热法,将锆离子(Zr)和 BDC-N3的反应物溶解于极性溶剂(DMF)中,随后进行搅拌,再通过金属盐与有机配体在耐压管中的自组装,合成叠氮化修饰的 UiO-66-N3纳米粒。为防止粒子间的相互聚集,我们选择末端带有炔基的两种 PEG,Alkyne- PEG- MAL和 Alkyne-PEG-OCH3,通过叠氮化物和炔基之间的“点击”化学反应,共价修饰 UiO-66-N3表面上的 PEG表面,在准备进一步靶向功能化的同时,提高 UiO-66的稳定性和生物利用度。
F3多肽在本研究中被选为肿瘤靶向配体,F3多肽来自于高迁移组蛋白 HMG-2 N端的31个氨基酸残基,F3肽的受体是新生血管内皮细胞和肿瘤细胞表面标记分子核仁素。在肿瘤细胞和肿瘤新生血管内皮细胞中,核仁蛋白在细胞表面表达。[[6]]因此,F3肽可以用作靶向作用于肿瘤组织的良好载体,并且可以通过携带针对肿瘤血管的药物来携带靶向药物。我们将半胱氨酸残基并入F3肽的C末端以促进其结合到UiO-66-N3的表面,以实现纳米粒子的主动靶向性。
合成 DOX/ UIO-66- PEG- F3纳米载药体系后,并同时进行 FT-IR,1 H-NMR, SEM,TEM,DLS,VIS-UV等的表征实验和体外释放实验。
第2章MOF材料UiO-66-N3的合成与表征
2.1引言
近年来,纳米有机金属骨架材料(nMOFs)逐渐成为各个领域的热点,其在生物医学领域的研究越来越多,其应用前景广阔。除了高载药量外,该材料还具有通用性,结构设计和可控性的优点。然而,目前其仍然存在一些缺点;如生物相容性不确定;有机溶剂易于用于制备过程;一些释放过程有突释现象;许多影响载药量不能精确控制因素(包括粒径),表面积和孔体积等。
UiO-66是目前金属-有机骨架材料中最稳定的材料之一,是一种以Zr为金属中心,对苯二甲酸( H2BDC)为有机配体的刚性金属有机骨架材料[[7]]。UiO-66的优势很明显,在水中具有极好的稳定性,但是体内会与一些常见离子例如磷酸根离子发生强烈的结合而使UiO-66结构不稳定,所以需要对其进行适当的表面修饰。本课题中,在相对较低的温度(低于180℃)条件下采用溶剂热法,利用BDC-N3作为有机配体,合成UiO-66-N3纳米颗粒。MOFs 的结构具有多样性,会受到很多因素的影响,不同的合成条件和影响因素会获得不同结构不同尺寸的的MOFs。在溶剂热合成中,例如pH,浓度,温度,反应时间等因素显得尤为关键。在本课题中,我们通过控制酸的添加量来控制UiO-66的尺寸,一般是盐酸或者醋酸,同时以DMF等高沸点试剂作为溶剂,使反应在耐压管中或者反应釜中进行。为了得到纯化的UiO-66-N3纳米颗粒,反应结束后通过离心洗涤2-3次除去反应体系的高沸点溶剂DMF,并进行干燥。为了防止粒子间的相互聚集,我们选择末端带有炔基的两种PEG,Alkyne-PEG-MAL和Alkyne-PEG-OCH3,通过叠氮化物和炔基之间的“点击”化学反应,共价修饰 UiO-66-N3表面上的 PEG表面,以提高UiO-66的稳定性和生物利用度,同时为进一步的靶向功能化做准备。选择Cu(I)催化叠氮化物和炔烃间的反应,炔烃和叠氮基团具有体积小,能量高,反应性分布窄,反应产率高,能在室温下和良性溶剂中反应的特点,并且它们对材料科学中的各种官能团和反应条件均具有良好的耐受性,可以较容易地被引入到纳米载体的表面。同时由于其具有较高的热力学驱动力,这些反应通常快速完成并且具有高选择性,仅产生单一产物。由于F3肽与所测试的几乎所有肿瘤细胞和肿瘤血管内皮细胞结合,因此它可以携带携带到肿瘤细胞中的重组分子,并且可以通过携带抗肿瘤血管携带靶向药物。因此在本课题中,我们选择带有半胱氨酸残基修饰的F3多肽作为靶向配体以实现纳米粒子的主动靶向性。我们将半胱氨酸残基并入F3肽的C末端以促进其结合到UiO-66的表面。F3多肽能选择性结合癌细胞表面过表达的核仁蛋白受体,并能通过核仁蛋白在细胞表面和内部间的穿梭引导纳米载体进入肿瘤细胞内部。在本课题中,选择装载DOX作为抗癌的模板药物和荧光显像剂。合成示意图如下:
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: