N-单甲基取代的胺类化合物的合成毕业论文
2020-02-19 13:40:19
摘 要
N-甲基化反应是有机合成和生物转化过程中一类重要的反应,N-甲基取代的胺类化合物在化工生物医药等相关领域有广泛的应用,其中N-甲基氨基酸是氨基酸修饰的一类重要衍生物,已被广泛用于药物化学和生物化学中,来改变构象,限制分子的灵活性和增强药效。将N-甲基氨基酸掺入肽中可增加其药代动力学有用的参数,如膜通透性,光解稳定性和构象刚度等,因此研究N-甲基胺和N-甲基氨基酸具有重要的意义。本论文准备以N-取代的羰基咪唑脲为原料在硼氢化钠和碘存在下在四氢呋喃中回流生成产物N-甲基胺衍生物的技术路线来研究N-甲基化反应。在实验过程中得到了多个甲基胺目标产物,并通过反复调整实验条件优化了实验工艺,所得结果对N-甲基胺化反应具有一定的指导意义。
关键词:N-甲基化反应;N-甲基胺;N-甲基氨基酸
Abstract
N-methylation reaction is an important reaction in organic synthesis and biotransformation. It has been widely used in chemical biomedicine and other related fields. N-methyl amino acid is an important modified amino acid and has been widely used. Used in medicinal chemistry and biochemistry to change conformation, limit molecular flexibility and enhance drug efficacy. The incorporation of N-methyl amino acids into peptides increases the useful parameters of its pharmacokinetics, such as membrane permeability, photolysis stability, and conformational stiffness, thus studying the N-methylamine and N-methyl amino acids. Significance. In this paper, the N-methylation reaction was studied by using N-substituted carbonyl imidazolium urea as a raw material in the presence of sodium borohydride and iodine in tetrahydrofuran to form a product N-methylamine derivative. Several methylamine target products were obtained during the experiment, and the experimental process was optimized by repeated adjustment of experimental conditions. The results obtained have certain guiding significance for N-methyl amination.
Key words: N-methylation reaction; N-methylamine; N-methyl amino acid
目录
第1章 绪论·································1
1.1 目的及意义·······························1
1.2 基本内容和技术方案···························4
第2章 实验过程及结果·····························5
2.1 N-取代的羰基咪唑脲的合成························5
2.1.1 以脂肪胺为原料···························5
2.1.2 以芳香胺为原料···························5
2.1.3 以异氰酸酯为原料··························6
2.1.4 以羧酸为原料·····························7
2.1.5 结论································8
2.2 N-甲基胺类化合物的合成·························9
2.2.1 条件优化······························9
2.2.2 分析·······························10
2.2.3 合成N-甲胺····························10
2.2.4 数据·······························11
2.2.5 结论·······························12
第3章 总结·································14
参考文献··································15
致谢····································17
第一章 绪论
1.1目的及意义
N-甲基化反应[1]是有机合成和生物转化过程中一类重要的反应,广泛应用于合成肥料、杀菌剂、合成皮革和聚合物中,甲基取代的胺类[2]化合物在自然界中无处不在。它们是氮化学中的基本试剂,常被用来生产溶剂、精细化学品、农业化学品、医药中间体、合成皮革、聚合物或配制剂等,还可作为催化剂出售。广泛存在于染料、天然产物、药物、精细化学品中,有的直接用作溶剂和配方剂。其中N-甲基氨基酸[3]是一类重要的修饰的氨基酸,已被广泛用于药物化学和生物化学中,来改变构象,限制分子的灵活性和增强药效。将N-甲基氨基酸掺入肽中可增加其药代动力学有用的参数,如膜通透性,光解稳定性和构象刚度等。因此研究N-甲基胺和N-甲基氨基酸具有重要的意义。常见的含N-甲基的药物有盐酸帕唑帕尼[4],它对血小板源性生长因子受体(PDGFR),血管内皮细胞生长因子受体(VEGFR)-2、及c-Kit等具有显著的抑制作用,对非小细胞肺癌、肾细胞癌、肉瘤等多类肿瘤有抑制作用,另外还有麻黄碱[5]、对氨基苯甲酸类局麻药、嘧啶类受体拮抗剂等。
制备甲基化胺的常用方法有直接甲基化法、还原胺化法[6]、通过中间体还原、其他方法。
传统上的N-甲基化伯胺方法[7]是通过使用剧毒并且危险的甲基卤化物如碘甲烷和硫酸二甲酯等作甲基化试剂,在碱的参与下完成。N-甲基仲胺是由卤代甲烷与过量的伯胺来合成,这通常是一个昂贵而浪费的方法,结果反应的产量通常取决于采用的胺的性质,且过量的原料胺必须除去,这也是一个比较麻烦的过程。
人们通常误以为采用烷基化试剂作为限制试剂就可以制备N-甲基仲胺。然而,即使亲电试剂的数量是有限的,质子化产物和起始胺之间的平衡速度也足够快,足以产生复杂的混合产物,这使得该方法并不能普遍适用。因此人们可以通过仔细的调整反应参数,如反应物的相对比例、反应温度、反应时间和使用添加剂,使N-甲基仲胺在产物中占优势。
另一种常见的方法是在无机碱存在的条件下实现上述转化。最传统的条件是根据起始原料胺的性质,在室温或加热下,在极性非质子溶剂(DMF、DMSO、MeCN)采用碱金属碳酸盐(例如K2CO3、Ag2O、NaH)。典型的条件是采用胺、卤代甲烷和碱的等摩尔比。这一方法也有不同的报道,例如芳香胺的N-甲基化通常在碳酸钾存在的情况下用卤代甲烷处理胺,在某些情况下加入碘化钾来促进反应。然而合成N-甲基苯胺往往是复杂的,因为难以避免同时生成N,N-二甲基苯胺。在卤代甲烷的存在情况下直接甲基化过量苯胺是不可行的,因为形成叔胺和季胺是主要的反应过程,所以难以制备出高收率的仲胺,因此这一方法并未得到普遍应用。同理,有机碱也可以用同样的方式来实现相同的转变。
由于N原子上孤对电子的高度碱性和亲核性,伯胺被认为极具反应活性,可对合成转染造成干扰。由于反应活性高,如前所述的直接烷基化通常具有较差的选择性,因此为了降低胺的亲核性,通常将胺保护起来,转化为衍生物。
N-保护的伯胺是许多有机合成中被广泛应用的中间体,尤其是在许多衍生物中,羧基酰胺和磺酰亚胺是最有效的保护策略之一。虽然被广泛应用,但这些过程的缺点是在某些情况下烷基化收率较低,这些基团往往难以除去。常见的脱保护方法需要强力的加热、在强酸强碱中加热以实现必要的劈裂。简单的酰胺(如甲酰胺、苯甲酰胺)通常是由相应的氯化羧酸与胺反应,由碱催化而成。
众所周知的Eschweiler-Clarke反应,其中使用过量的甲酸和甲醛通过还原胺化将伯胺或仲胺甲基化。然而,基于绿色甲基化试剂的替代新催化方法的开发引起了很多关注。
从本世纪初开始人们就知道胺与甲醇直接甲基化的原理,单这些反应通常只在金属催化剂存在的情况下进行,反应条件往往难以应用。此外只有较少描述用醇来烷基化脂肪族胺的文献。一个典型的例子是正丁胺的甲基化反应是使用甲醇,单选择性的产生二甲基化产物。醇也可以在过渡金属催化剂(如镍、铑、钌)作用下与胺反应,尽管这些方法对单-N-烷基化有选择性,它们的缺点是在均相反应,在这种条件下,去除和回收催化剂的分离过程本质是冗长的,且金属催化剂通常都是昂贵的。
最近几年发展的以二氧化碳为碳源胺的甲基化反应:当然使用氢气为还原剂是最为绿色的反应,也有实现工业化的潜在可能性。但是当使用氢气为还原剂时,反应条件比较苛刻,需要的反应压力很高(此时原料中有两种反应物是气体,必然导致反应压力的升高),反应温度也较高,要真正实现工业化还有很长的路要走。使用硼烷做还原剂时,可以在温和条件下,实现胺的甲基化反应,但是硼烷比较昂贵,且活性较高,对实验操作要求比较严格。相对来说氯硅烷是一个比较合适的还原剂来实现二氧化碳和胺的甲基化反应[8],反应条件较为温和,且实验操作简便。
另外,碳酸二烷基酯,特别是碳酸二甲酯(DMC),已被证明是在极其剧烈的条件下(高温和高压,通常高于160℃),通过亲核试剂如醇、伯胺和活化的苄基衍生物,是有用的亲电子甲基化试剂。碳酸二烷基酯,特别是碳酸二甲酯(DMC)被证明在极其剧烈的条件下(高温和高压,通常高于160℃)是有用的亲电甲基化试剂。
通过亲核试剂如醇,伯胺和活化的攻击,是有用的亲电子甲基化试剂。苄基衍生物,在DMC的甲基碳上,导致形成作为副产物的CO2和甲醇。
在温和条件下,通过攻击DMC的羰基碳,DMC也用作甲氧基羰基化试剂。有趣的是,与传统的甲基化试剂相比,碳酸二烷基酯是无毒且易于处理的化合物,是传统溶剂和试剂的有吸引力的环保替代品。
前述方法尤其是直接甲基化的方法的化学选择性和产率远非理想。直接单-N-甲基化中固有的过度甲基化的困难导致间接单-N-甲基化方法的发展以改善选择性。在间接单甲基化方法中,最常见的方法包括多步骤方法,包括胺保护,然后甲基化和去保护。然而,额外的保护和去保护操作导致繁琐的劳动力工作,产量损失以及显着的成本增加。因此,还原甲基化已被开发为用于伯苯胺的间接单-N-甲基化的有效方法。
然而,己经报道的这些催化体系中的催化剂的合成一般比较复杂,价格比较昂贵,且多数催化剂催化反应的选择性不高,经常会产生N-甲酰化产物。因此寻找低毒、廉价、高效、高选择性的方法合成N-甲基胺仍显得十分必要。
本论文在对已报道的合成方法详细调查的基础上,提出了一种新的合成单-N-甲基胺类化合物的方法。为了得到单甲基取代的产物,我们选择了通过中间体还原甲基化的方法,因此,选择一个合适的中间体非常重要。之前我们报道过通过N-取代的羰基咪唑化物在室温下采用硼氢化钠还原得到甲酰胺的制备方法,由于甲酰胺很容易被还原成甲基胺,于是我们联想到可以有N-取代的羰基咪唑化物两步一锅合成甲基胺类化合物。
经调查发现,N-取代的羰基咪唑内酯是非常有吸引力的中间体,具有适合的分离或储存稳定性,并且我们已经通过使用不同的起始原料如胺,异氰酸酯和羧酸开发了各种制备它们的好方法。由于羰基咪唑内酯部分的羰基碳原子容易被亲核试剂攻击而且咪唑基易于解离,因此N-取代的羰基咪唑内酯具有良好的反应性,并已广泛用于合成各种有价值的产品,如脲,氨基甲酸酯,硫代氨基甲酸酯,氰基甲酰胺。
此方法是对合成单-N-甲基胺类化合物的方法的一种补充,同时也是对N-取代的羰基咪唑化物应用的拓展。且该方法的适用范围可不仅限于芳香族胺的底物,它同时可以通过N-取代的羰基咪唑化物的制备来拓展至各种底物,如脂肪族胺、异氰酸酯和羧酸。
1.2基本内容和技术方案
在以前的工作中,我们采用合成中间体N-取代的羰基咪唑[9],然后经过硼氢化钠[10]还原可以得到甲酰胺,故我们可以采用更强的还原剂:NaBH4/I2的体系[11]进行还原可以得到N-甲基胺。该方法是以羧酸、胺、异氰酸酯等为原料,采用文献报道的方法制备中间体N-取代的羰基咪唑,然后进行还原得到N-甲基胺。
拟采取的研究方案:
首先采用羧酸、胺、异氰酸酯等为底物以合适的方法来合成中间体N-取代的羰基咪唑脲,再以相应的中间体N-取代的羰基咪唑脲为原料在硼氢化钠和碘存在下在四氢呋喃中回流生成产物N-甲基胺衍生物。拟采取的技术路线:
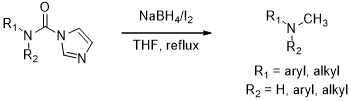
第二章 实验过程及结果
2.1 N-取代的羰基咪唑脲的合成
2.1.1.以脂肪胺为原料
脂肪胺,是指碳链长度在C8-C22范围内的一大类有机胺化合物,它与一般胺类一样,分为伯胺、仲胺和叔胺及多胺四大类,而伯、仲、叔胺则取决与氨中的氢原子被烷基取代的数目。脂肪胺的市场价格较为便宜,十分容易获取,是一种用途非常广泛的化工原材料。在这里我们以苯乙胺作为脂肪胺的代表,用苯乙胺作为底物来进行N-取代羰基咪唑脲中间体的合成
实验步骤:室温(20-30℃)下,在250mL圆底烧瓶中加入100mLDCM,将5.0mmol脂肪胺加入搅拌溶解,之后加入2g(11mmol)CDI,反应液继续搅拌3-6小时。采用TLC法 [12]监测原料反应情况。反应完毕后,加入DCM稀释反应液,然后用10%的食盐水(100mL*2)洗涤两次,合并DCM,加入无水的Na2SO4干燥,然后进行过滤,滤液于减压下除去DCM得到粗品,粗品通过过柱子法进行纯化。
1 |
|
|
按照预定好的实验步骤完成实验过程之后,我们得到了一定的产物,然后分别用层析法和核磁检测来验证确认产物为目标产物,并计算相应的产率,最终我们得到了以下的产物数据,基本性状以及核磁氢谱数据:
N-苯乙基-1H-咪唑-1-甲酰胺(1b):性状为黄色的固体,产率89%,Rf=0.5 (EA/PE = 2/1). 核磁数据如下: 1H NMR (400 MHz, CDCl3, ppm): δ = 8.00 (s, 1H), 7.73 (t, J = 5.6 Hz, 1H), 7.41 (t, J = 1.4 Hz, 1H), 7.33 – 7.20 (m, 5H), 6.89 (s, 1H), 3.65 (dd, J = 12.0 Hz, 6.8 Hz, 2H), 2.95 (t, J = 8.0 Hz, 2H).
2.1.2以芳香胺为原料
芳香胺是指具有一个芳香性取代基的胺——即-NH2、-NH-或含氮基团连接到一个芳香烃上,芳香烃的结构中通常含有一个或多个苯环。苯胺是这类化合物最简单的实例,它的市场价格便宜容易获取,在化工领域有着广泛的应用,是一种优质的原材料。在这里,我们就以N-甲基苯胺作为芳香胺的代表,用苯胺作为底物来进行N-取代羰基咪唑脲中间体的合成。
实验步骤:于20-30℃下,在100mL圆底烧瓶中加入20mL二氯甲烷(DCM)后,一边搅拌下将5.0mmol化合物a(如N-甲基苯胺)加入烧瓶中,溶清后加入0.89 g(5.5mmol)CDI,加毕,开始滴加二异丙基乙胺(DIEA,0.8mL,5.0mmol),将反应升温至50-60℃,继续反应5-12小时。采用薄层色谱法监测原料反应情况。待反应结束以后,反应液用冰水浴降温至20-30℃,在反应液中加入30mL二氯甲烷进行稀释,然后用10%浓度的食盐水(50mL)洗涤两次,合并有机层(下层),固体无水Na2SO4干燥2小时,过滤,滤液于减压下除去DCM得到粗品,粗品通过柱色谱法纯化。
2 |
|
|
按照预定好的实验步骤完成实验过程之后,我们得到了一定的产物,然后分别用层析法和核磁检测来验证确认产物为目标产物,并计算相应的产率,最终我们得到了以下的产物数据,基本性状以及核磁氢谱数据:
N-甲基-N-苯基-1H-咪唑-1-甲酰胺(2b): 性状为白色固体,产率 80%,Rf=0.6 (EA/PE = 3/1). 核磁核磁数据为: 1H NMR (400 MHz, CDCl3, ppm): δ = 7.55 (s, 1H), 7.35 (t, J = 7.2 Hz, 2H), 7.28 (t, J = 7.2 Hz, 1H), 7.09 (d, J = 7.2 Hz, 2H), 6.81 (s, 1H), 6.77 (s, 1H), 3.46 (s, 3H)
2.1.3以异氰酸酯[13]为原料:
异氰酸酯是异氰酸的各种酯的总称,若以-NCO基团的数量分类,包括单异氰酸酯R-N=C=O和二异氰酸酯O=C=N-R-N=C=O及多异氰酸酯等。单异氰酸酯是有机合成的重要中间体,容易与包含有活泼氢原子的化合物:胺、水、醇、酸、碱发生反应,与胺类化合物反应通常生成取代脲,所以我们可以以异氰酸酯为底物与咪唑进行反应获得N-取代的羰基咪唑脲。

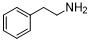 1a
1a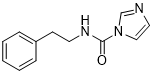 1b
1b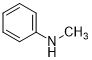 2a
2a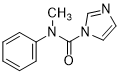 2b
2b


