氯喹啉对大鼠CYP450酶的自动诱导作用与CYP3A和CYP1A有关外文翻译资料
2022-09-06 11:14:02

英语原文共 11 页,剩余内容已隐藏,支付完成后下载完整资料
氯喹啉对大鼠CYP450酶的自动诱导作用与CYP3A和CYP1A有关
摘要
为探讨一种新颖的抗肿瘤药物---氯喹啉(CXL),对CYP450酶的自动诱导作用,本研究开展了三项关于CYP450酶的诱导实验:a)体外使用大鼠原代肝细胞模型;b)体内建立CYP450酶探针的“鸡尾酒”模型;c)单剂量和多剂量给药的药代动力学(PK)研究。这些实验都运用了几种典型的CYP酶探针底物和诱导剂,而且它们都可以通过HPLC-MS/MS检测。另外,还可以通过实时聚合酶链式反应(RT-PCR)技术来检测CYP3A和CYP1A的mRNA的表达水平。其中,PK研究结果表明,多剂量给药时,其血药浓度与时间曲线下的峰面积(AUC0-t)和峰值浓度(Cmax)分别要比单剂量给药时小2.4倍和1.9倍左右(P lt;0.05)。后续研究探讨了CXL对CYP450的可能诱导作用。另外,CYP450探针的体内“鸡尾酒”模型结果显示,当用CXL预处理样品5天时,CYP3A酶的代谢物/探针血浆比率要比阴性对照组高平均4.6倍; 而CYP1A酶的代谢物/探针血浆比率要比阴性对照组高336%(P lt;0.05)。再通过四种不同浓度(1,10,50和100mu;mol/L)的CXL来进一步评估其对大鼠肝细胞CYP450的诱导作用。与阴性对照组相比,用10,50和100mu;mol/L的CXL(P lt;0.05)治疗大鼠肝细胞后的CYP1A2的mRNA水平具有显著的增加。而对CYP3A1的显著诱导则在所有的浓度中都可观察到。本研究的结果表明CYP3A和CYP1A的表达增强和诱导是响应于CXL作用于大鼠的结果,这说明CXL是CYP3A和CYP1A的自动诱导物。
介绍
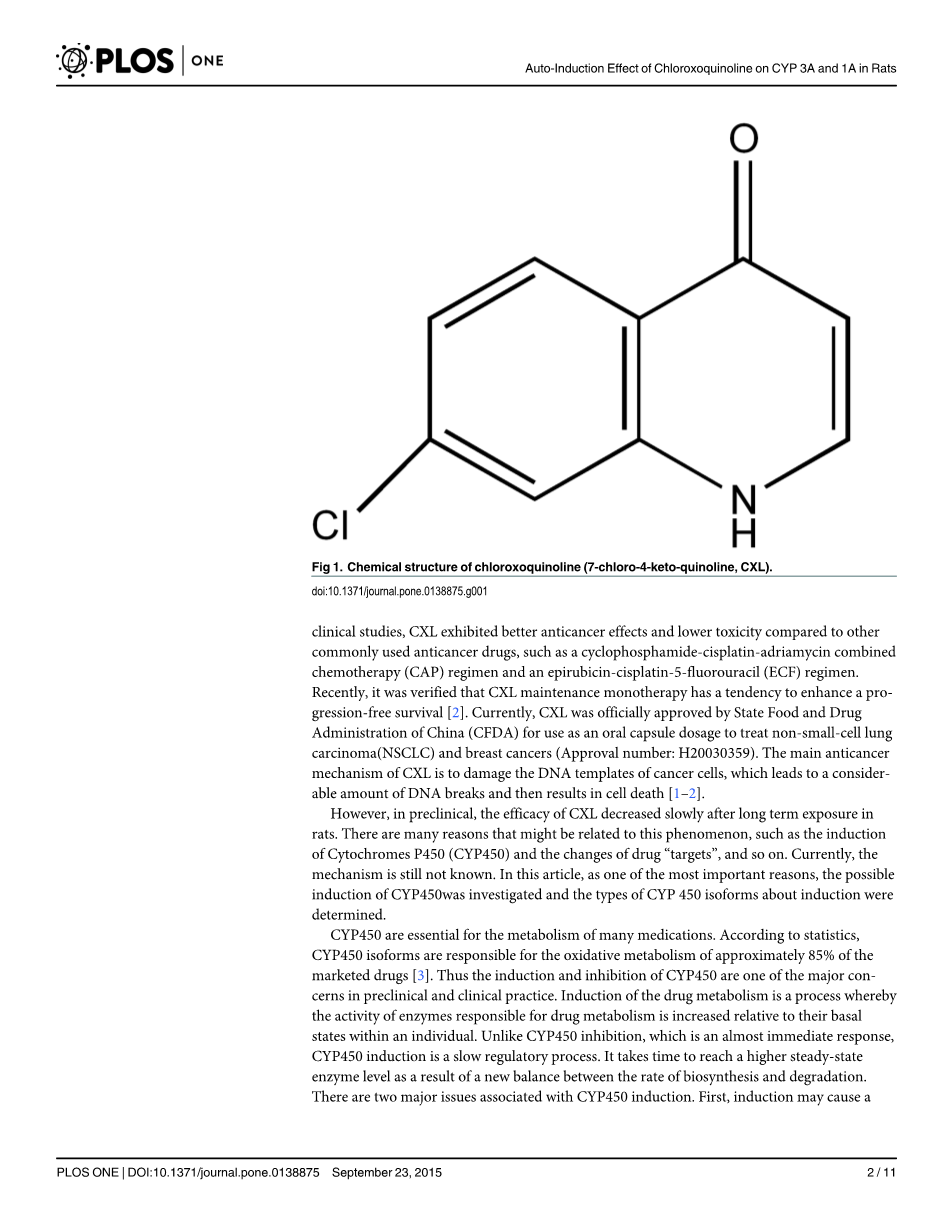
氯喹啉(CXL)[7-氯-4-酮-喹啉],是一种新颖的抗癌药物,具有如图1所示的新的化学结构。在临床前的研究中,CXL能增强荷瘤小鼠Lewis肺癌细胞和异种移植肿瘤中的辐射灵敏度。
图1 氯喹啉(CXL)[7-氯-4-酮-喹啉]的化学结构
在临床研究中,相比其他常用的抗癌药,诸如环磷酰胺-顺铂-阿霉素组合化疗(CAP)方案和表阿霉素-顺铂-5-氟尿嘧啶(ECF)方案,CXL表现出更好的抗癌效果和更低的毒性。最近,有人证实CXL单一疗法具有增强无进展生存的倾向。目前,CXL正式被我国家食品药品监督管理局(CFDA)批准用作口服胶囊剂型以治疗非小细胞肺癌(NSCLC)和乳腺癌(批准文号:H20030359)。CXL主要的抗癌机制是破坏癌细胞中的DNA模板,这导致了相当数量的DNA断裂,然后导致细胞死亡。
然而,在临床前,CXL的功效在长期接触大鼠后有缓慢的下降。这有许多原因,可能与该现象有关,如细胞色素P450(CYP450)的诱导和药品“指标”的变化,等等。目前,该机制仍然是未知的。在这篇文章中,作为最重要的原因之一,本研究调查了CYP450的可能性诱导,而且确定了CYP450的相关亚型结构。
CYP450是许多药物的代谢过程中必不可少的部分。据统计,CYP450亚型负责约85%上市药物的氧化代谢。因此, CYP450的诱导和抑制是临床前和临床实践中的主要问题之一。药物代谢的诱导是一个过程,由此负责药物代谢的酶的活性相对于它们的单独的底物有所增加。不像CYP450近似瞬间反应的抑制作用, CYP450诱导作用是一个缓慢的监管过程。它需要时间来达到更稳定状态的酶的水平,这是生物合成与降解的速率达到新的平衡的结果。另外还有与CYP450诱导作用相关的两个主要问题。首先,诱导可能导致联合给药药物的治疗功效的降低。对于其药效是由母体药物主要产生的药物,诱导作用将增加药物的消除,从而降低了药物浓度,并减少药物的药理作用。其次,诱导作用可能造成通过解毒和活化来增加活性代谢物的形成的结果之间的不良的不平衡状态,并导致代谢物相关的毒性增加的危险和/或潜在的药物之间的相互作用(DDI)。
本文的目的在于调查其可能存在的自动诱导机制。本实验运用了三个体外和体内大鼠模型:a)体外大鼠肝细胞诱导模型; b)体内“鸡尾酒”实验模型;c)单剂量和多剂量给药的药代动力学研究。
材料和方法
道德声明
本研究没有涉及到非人类的灵长类动物。本篇文章中描述的实验是完全按照动物卫生研究所发布的动物实验的指导原则进行的。本项研究是经北京理工大学药理学和毒理学下的动物伦理委员会所批准的(道德规范许可证编号SCXK-(北京)2007-004)。此外,该项目是在开展研究工作之前收到批准许可的。
材料
由茂祥制药有限公司生产的CXL(纯度gt;99.3%,中国,吉林,通化);非那西丁,副黄嘌呤,地塞米松(DEX),beta;-萘黄酮(BNF),4-乙酰氨基苯酚,从Sigma-Aldrich Inc.公司(美国,密苏里州,圣路易斯)得到的1- 羟基咪达唑仑和还原型辅酶Ⅱ(NADPH);从国家食品药品检验所(中国,北京)买来的咖啡因,盐酸咪达唑仑,盐酸曲马多和盐酸普萘洛尔。 Kolliphor HS15作为增溶剂,由中国BASF有限公司(中国,北京)授予。从BD Gentest公司购买的大鼠重组细胞色素P450酶(CYP1A2和CYP3A1)与还原酶(美国,马萨诸塞州,沃本)。 HPLC级乙腈和甲醇从Sigma-Aldrich Inc.公司(美国,密苏里州,圣路易斯)获得。所有其它试剂和溶剂均为分析性的商业产品等级。所有引物由AuGCT生物技术(中国,北京)合成。
动物
从Vital River实验室(中国,北京)获得的200plusmn;20克的雄性SD大鼠。这些老鼠的等级是二级。所有的动物都是在标准笼子里,12小时光/暗周期循环,并在该标准下给予化学食品和水,可以维持至少1周。
体外使用大鼠肝细胞诱导模型对CYP450诱导评价
如先前所述进行此过程。简要地说,原代肝细胞是通过两步胶原酶灌注法的变形来从成年Sprague-Dawley大鼠(200到220克)体内分离出来的。然后,大鼠肝细胞的生存能力通过台盼蓝试验来评价,并添加高于70%生存力的细胞悬液。将活肝细胞接种到人工基底膜涂层的24孔板中,每孔含密度为1mL 孵化溶液介质中有1times;106的活细胞。孵育培养基为Hepatozyme-SFM(加利福尼亚州,卡尔斯巴德,Invitrogen公司),并在整个实验过程中每24小时变化一次。用CXL处理前的肝细胞需要首先在湿润的CO2培养箱(37℃,5%CO2)中保存3天。在第四天,将培养基吸出并弃去,然后用不同CXL(含0.1%DMSO)或阳性对照组(PC,包含BNF或DEX)或阴性对照组(NC,含0.1%DMSO)处理3天。在第四天,通过在所协议的厂家里买到的Trizol A 试剂(中国,天根)立即从细胞提取所有的RNA。之后运用实时聚合酶链式反应(RT-PCR)技术,该技术是用一个带有探针的IQ5的RT-PCR检测系统(Bio-Rad公司,福斯特城,加利福尼亚州,美国),其RT-PCR主要混合液试剂含有300nM的正向引物,900nM的反向引物,200nM的TaqMan探针和25 ng的总RNA。该RT-PCR模式如下:在48℃下逆转录25分钟,在95℃下酶被激活15分钟,并在95℃下、15秒内变性44个周期,退火/延伸1分钟。在PCR扩增中使用的引物如下:
CYP3A1正向: TTCACCGTGATCCACAGCA和CYP3A1反向:TGCTGCCCTTGTTCTCCTT;CYP1A2正向:CCTCACTGAATGGCTTCCACA,CYP1A2反向:TCTCATCATGGTTGACCTGCC;GAPDH正向:GTGGTGCCAAAAGGGTCAT和GAPDH反向:ATTTCTCGTGGTTCACACCCA。
带有CYP重组酶的CXL的代谢模式
将CXL溶于乙腈并用0.1%浓度的该溶剂来稀释培养缓冲液。 另用4mu;mol/ L的CXL在磷酸钠缓冲液(100mmol/L,pH7.4)中单独孵育,该缓冲液含有CYP1A2重组体和与细胞色素B5协同表达的CYP3A1 ,该体系最终体积为1mL。20 nmol/L的P 450的蛋白质浓度中使用了索米。将该缓冲液体系在37℃下预孵育5分钟后,加入1.0 mmol/L的NADPH,开始实验。 0,10,30和60分钟后,从孵育液中抽出100 mu;L液体弃去并加入100 mu;L混有曲马多(内标,100 ng/mL)的冷乙腈。将样品混合并置于湿冰上。在14000g的离心力下离心10分钟,取上清液进行如上所述的LC-MS / MS分析。孵育一式分三份进行。
CYP450探针底物及其代谢产物的体内鸡尾酒模型
将九只雄性大鼠随机分配到一个阴性对照组(NC),一个阳性对照组(PC)和一个实验组(n = 3)。实验组给予60mg/kg的CXL(含有0.5%甲基纤维素,PO,每天两次),而阴性对照组给予0.5%甲基纤维素。阳性对照组给予25mg / kg的地塞米松(含有0.5%甲基纤维素,PO,每日两次)。在第六天,这三组大鼠的腹腔内分别给予了“鸡尾酒”探针底物,其中包括咖啡因(1mg/kg)和咪达唑仑(0.2mg/kg)。然后在10,20,30分钟和1,3小时后取血液样品(约200mu;L)。这些血液样品在3500g的离心力下离心10分钟,然后收集50mu;L血浆样品,与150mu;L乙腈(含有20ng/mL普萘洛尔,作为I.S.)混合以作为内标(I.S.)和蛋白质沉淀剂。将该混合物剧烈振摇1分钟,在14000的离心力下离心10分钟(4℃),然后各样品取20mu;L以注入HPLC-MS / MS系统来进行底物以及其代谢物的分析。如之前中描述均表现出相对引用结果。
用HPLC-MS/ MS分析体内探针底物和其代谢产物
在该实验中,咖啡因,副黄嘌呤(咖啡因的代谢物),咪达唑仑,1-羟基咪达唑仑(咪达唑仑的代谢产物)和普萘洛尔(I.S.)都是通过HPLC-MS/MS方法来同时确定的。该方法与体外探针底物的代谢物的分析方法类似。通过使用正离子多反应监测(MRM)模式来分析咖啡因从质荷比195到138(碰撞能量:29 eV)的转变过程,副黄嘌呤从质荷比181到124(碰撞能量:26 eV)的转变过程,咪达唑仑从质荷比326到249(碰撞能量:51 eV)的转变过程,1-羟基咪达唑仑从质荷比342到324(碰撞能量:23 eV)的转变过程和普萘洛尔从质荷比260到118(碰撞能量:23 eV)的转变过程。
体内单剂量和多剂量给药的药代动力学研究
在本实验中,六只雄性大鼠被随机分配到单剂量组和多剂量组中,并且按照人体临床方案(20-30 mg/kg/天,TID)即口服剂量给药60 mg/kg来研究CXL的药代动力学内容。此给药制剂(10mg/mL)可在20%Kolliphor HS15材料中制备并通过管饲法以口服给药,剂量为6mL/kg。对于单剂量组,在单次给药后的5,15,30,45分钟,1,1.5,2,4,6,8和12小时时收集200mu;L的血液样品。对于多剂量组,应在接下来的5天内每日给大鼠给药两次相同剂量CXL。为达到稳定的血药浓度状态,在每次给药前收集200mu;L最低血药浓度(Cmin)的样品。最后,在多剂量给药结束时,须再次收集与单剂量给药后的同一时间点的血液样品。将这些血液样品在3500g离心力下离心10分钟,然后收集50mu;L的血浆样品并加入50mu;L的曲马多溶液(1mu;g/mL的甲醇溶液)以作为内标(I.S.)。再加入100微升蛋白沉淀剂(乙腈)后,将该混合物涡旋30秒,然后以14000g离心力离心10分钟。将上清液转移到干净的小瓶中以对CXL进行分析。
通过LC / MSD技术量化CXL生物系统
LC/MSD四倍质谱仪系统(美国,加利福尼亚州,帕洛阿尔托,安捷伦科技)可以用来量化CXL。该配备包括二元泵,自动溶剂脱气装置,自动取样器和一个BetaBasic(美国,马萨诸塞州,沃尔瑟姆,赛默飞世公司)的C18柱(内径2.1mmtimes;150mm,5mu;m)。流动相为甲醇 - 水 - 甲酸(65:35:0.1,V / V / V),流速为0.2mL/min。其检测是在可选择的离子监测(SIM)模式操纵的电喷雾离子化(ESI)源下进行的。 检测CXL离子的模式为 [M H] ,质荷比180;检测曲马多离子(I.S.)的模式为[M H] ,质荷比264。另外,ESI的最佳条件包括40磅的压力,喷雾压力4500V、喷速9L/min、300℃下的氮气干燥气体,1600的检测器和100V的碎裂电压。各样品加入到柱子里的体积分别为10mu;L。 CXL和曲马多的保留时间分别为2.7和1.9分钟。利用分析物与内标之间的峰面积比对比加权(1/x)后的浓度并通过最小二乘线性回归方法来定量CXL。该方法中超过浓度从0.01到10.0mu;g/mL的范围的函数为线性关系。
数据的处理及分析
对于CYP450诱导作用的体外评价,所有样品的Ct值均减去甘油醛-3-磷酸脱氢酶(GAPDH)的Ct值以得到相对值(Delta;Ct),然后将每
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[146941],资料为PDF文档或Word文档,PDF文档可免费转换为Word




