GSHPH双响应的巯鸟嘌呤前药胶束的体外生物学评价毕业论文
2020-03-04 08:54:23
摘 要
化学疗法是大多数癌症治疗中不可或缺的手段,但其毒副作用仍然是一个巨大的挑战。近年来,响应性聚合物胶束由于其对特异性环境的高度敏感性在抗肿瘤药物传递领域备受关注。本文的目的是运用本课题组先前制备的巯基鸟嘌呤-醛基海藻酸钠(6-TG-ASA)大分子前药构建一种pH和谷胱甘肽双响应的巯基鸟嘌呤聚合物前药胶束,并对获得的聚合物前药胶束进行体外生物学评价。本文主要的研究内容及结果如下:
(1)双响应性大分子前药胶束的制备及其形态和大小的表征。
以6-TG-ASA为原料,在水溶液中超声辅助自组装制得6-TG-ASA大分子前药胶束,采用透射电子显微镜TEM和动态光散射仪DLS表征了胶束的形态和大小。结果显示所制得的大分子前药胶束具有核壳结构,大小为98.4 ± 4.87 nm。
(2)双响应性大分子前药胶束的双响应性研究。
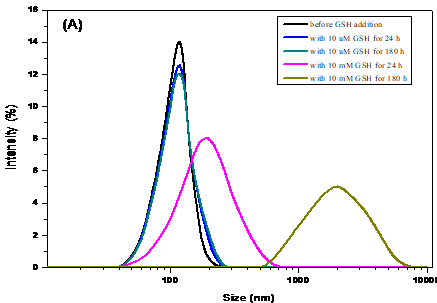
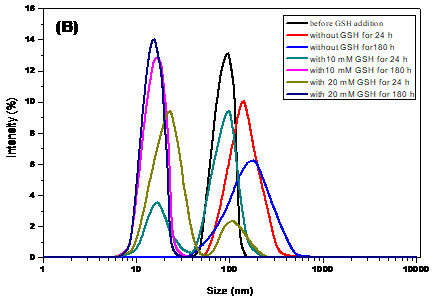
通过DLS表征了在不同pH缓冲溶液中及在不同GSH浓度条件下,大分子前药胶束的粒径尺寸变化,证实了大分子前药胶束的pH和GSH双响应性。
- 双响应性大分子前药胶束的体外释药实验、细胞毒性与摄取评价。
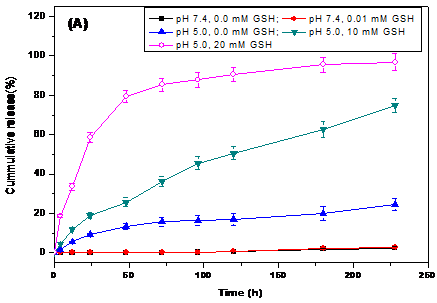
分别研究了胶束在不同GSH浓度的pH 7.4和pH 5.0溶液中的体外释药,发现在10 μM 谷胱甘肽(glutathione, GSH)、pH 7.4的缓冲介质中几乎不释放药物;而在20 mM GSH、pH 5.0缓冲介质中药物的累积释放明显高于10 mM GSH、pH 5.0缓冲介质中的释放。前药胶束相较于游离的6-TG对HL-60细胞有更高的细胞抑制率。负载荧光染料尼罗红(NR)的聚合物前药胶束能被HL-60癌细胞有效摄取并在癌细胞内释放出NR,这就意味着聚合物前药胶束能在癌细胞内响应GSH和pH刺激分解,将键合的药物分子6-TG释放出来。
关键词:双响应性;前药胶束;大分子聚合物;纳米系统
Abstract
Chemotherapy is an indispensable mean in most cancer treatment, but its toxic side effect is still a great challenge. In recent years, responsive polymer micelles have attracted much attention in the field of antitumor drug delivery due to their high sensitivity to specific environment. The purpose of this article is to construct a pH and glutathione dual response polymeric prodrug micelle system by using the thiol guanine-aldehyde sodium alginate (6-TG-ASA) macromolecular prodrugs which had previously prepared by our group, and evaluate its in vitro biological properties. The main research contents and results are as follows:
(1) Preparation, morphology and size characterization of prodrug micelles for biresponsive macromolecules.
With 6-TG-ASA as the raw material, 6-TG-ASA prodrug micelle was prepared by ultrasonic assisted self-assembly in aqueous solution. The morphology and size of micelle were characterized by TEM and DLS. The results showed that the micelle had nuclear shell structure and the size was 98.4 ± 4.87 nm.
(2) Study on the dual-responsiveness of dual-response macromolecular prodrug micelles.
Through DLS, the particle size changes of the micelles under different pH buffer solutions and GSH concentration conditions were characterized, which confirmed the pH and GSH double responsiveness of the micelles.
(3) Study on in vitro drug release experiment, cytotoxicity and uptake evaluation of dual-response macromolecular prodrug micelle.
The in vitro release of micelles in pH 7.4 and pH 5.0 solutions with different GSH concentrations was studied. We found that almost no drug was released in the buffer of 10 mM GSH and pH 7.4. And in 20 mM GSH and pH 5.0 buffer, the cumulative release of drugs was significantly higher than that in 10 mM GSH and pH 5.0 buffer. Compared with the free 6-TG, the prodrug micelles had a higher cell inhibition rate for HL-60 cells. The 6-TG-DSA prodrug micelles loaded with fluorescent dye Nile Red (NR) could be efficiently taken up by HL-60 tumor cells and released the encapsulated NR in the cytosol, which indicated that the polymer prodrug micelles could release the bond drug 6-TG in respond to GSH and pH-stimulation in cancer cells.
Key words: Dual responsiveness; Prodrug micelles; Macromolecular polymer; Nano-system
目录
摘要 I
Abstract II
第一章 绪论 1
1.1纳米药物传递系统 1
1.2聚合物胶束 1
1.3刺激响应性聚合物胶束 2
1.3.1 pH敏感性聚合物胶束 2
1.3.2氧化还原敏感性聚合物胶束 3
1.3.3 氧化还原/pH敏感双响应聚合物胶束 3
1.3.4 聚合物胶束的应用 4
1.4 聚合物前药胶束 5
1.5 海藻酸钠 5
1.6 6-巯基鸟嘌呤 6
1.7 研究内容及意义 6
第二章 双响应性大分子前药胶束的制备及其表征 8
2.1引言 8
2.2 实验部分 8
2.2.1 仪器与材料 8
2.2.2 两亲性海藻酸钠大分子前药胶束的制备及其形态观察 9
2.2.3海藻酸钠大分子前药胶束的pH敏感性和GSH响应性 10
2.3 结果与讨论 10
2.3.1 海藻酸钠大分子前药胶束的制备 10
2.3.2 海藻酸钠大分子前药胶束的形态观察 10
2.3.3 海藻酸钠大分子前药胶束的GSH响应性和pH敏感性研究 11
第三章 双响应性大分子前药胶束的体外释药实验 14
3.1引言 14
3.2 实验部分 14
3.2.1 仪器与材料 14
3.2.2 绘制6-巯基鸟嘌呤标准曲线 15
3.2.3 研究大分子前药胶束的体外释药行为 15
3.3 结果与讨论 16
第四章 双响应性大分子前药胶束的细胞毒性研究与摄取评价 18
4.1 引言 18
4.2 实验部分 18
4.2.1 仪器与材料 18
4.2.2 研究双响应性大分子前药胶束的体外细胞毒性 19
4.2.3 研究双响应性大分子前药胶束的细胞摄取 19
4.3结果与讨论 20
第五章 结论 23
参考文献 24
致 谢 27
第一章 绪论
1.1纳米药物传递系统
纳米技术是将研究物质的粒径大小等特征控制在纳米级别来进行设计、制备、生产和应用的一种技术,是科学的一个多学科分支,涵盖了生物医学、制药、农业、环境、化学科学、物理等多种多样的科学和技术领域。新开发的纳米材料的表面改性对于细胞修复、药物传递、治疗应用、诊断辅助等应用很重要[1-2]。近年来,越来越多的纳米技术应用于药物研究领域中,尤其是在药物传递系统(DDS)的应用得到了越来越多的关注,使纳米级别的药物较好地实现了给药靶向性、缓控释性,并在很大程度上提高了药物的溶解度和生物利用度,同时在一定程度上降低了药物的用量和毒副作用等。
纳米粒子是指粒度大小在10-1000 nm之间的微粒,形态各异。纳米粒在体内具备较高的稳定性、粒径大小易于调节及小尺寸、高体积比等显著优势而备受关注,在生物医学等领域内的发展也越来越好,并伴随着一系列新的功能特点呈现,如功能化及其结合生物分子更加容易等。
纳米药物传递系统(NDDS)是以靶点为靶细胞,能靶向性地将目的药物传送至靶点部位,从而实现药物高效性和低毒性相结合的给药体系,此类微粒给药体系的一般粒径大小位于10~1000 nm间。用载体材料包裹纳米药物来运输药物粒子而制成的纳米级药物,早期所应用的纳米药物载体高分子材料主要是蛋白质和多糖这两类,虽然具备可以天然生物降解的特征,但仍然因为其质控性不高、不容易制备得到等,如今而未被广泛应用。现阶段所采用的纳米药物载体材料主要为具备低毒性、高生物相容性的天然大分子体系和人工合成的高纯度、高质控性、高选择性的高分子聚合物。纳米药物传递系统具备特有的优势,可靶向性给药、控制药物缓控释性并对减少药物的毒副作用也有一定的作用,利用纳米系统来治疗癌症愈来愈有吸引力。
但在现阶段中,纳米级药物的使用仍然还存在着一些问题:只有一部分的药物适合做成纳米级别,而不是所有的药物都适合;纳米药物的粒度过小,使载药能力与载药率很大水平上受到纳米级尺寸的限制影响;纳米药物的原辅料价格昂贵、制备工艺的选择性较差、产率也相对不高、后处理过程也比较繁琐复杂、运输过程需小心谨慎等[3]。纳米药物虽存在不足之处,将具有良好性能优势的纳米药物合理地运用到药物传递系统中来仍然是今后研究的重点。
1.2聚合物胶束
化学治疗剂通常不溶于水,存在循环时间短和毒副作用高等缺点。在过去的一个世纪中,科学家们已经做出了巨大努力来规避这些局限性并改善抗癌疗法的治疗益处。随之,纳米载体成为癌症治疗领域颇具吸引力的研究领域,包含脂质体,胶束和其他材料制成的纳米粒子。
聚合物纳米粒可制成药物运输载体,进而可实现纳米粒尺寸及表面一些特性的可控制特性,使纳米粒可以实现高效、靶向释放包载其中的药物。将聚合物纳米粒运用到药物传递系统中来存在着很多优势:(1)纳米粒的可控式粒径及表面特性;(2)纳米粒可实现药物的靶向性释放及低毒性;(3)纳米粒具备较高的载药率且药物不容易被化学反应失活;(4)纳米粒可应用于多种不同途径的给药方式中等[4]。
聚合物胶束是广泛研究的用于输送水溶性差的药物的载体,与别的药物载体相比,胶束具有较小的尺寸(10-1000 nm)及可实现靶向性的优点,可用于被动靶向实体瘤,尤其是血管化差的肿瘤。胶束具有各种不相同的形状,如囊泡,小管,薄片,球形和棒状,具体的形态取决于疏水性/亲水性嵌段的相对长度以及所处的溶剂环境。值得注意的是,胶束的形态对胶束的药物动力学性质有着较明显的影响。例如,蠕虫状胶束的循环时间比类似材料制成的球形外壳要长十倍。
聚合物胶束用作药物释放的载体时需要满足以下条件:
(1)需具备良好的生物相容性以及生物可降解性等性能;
(2)可以改善疏水性药物的溶解度或具备有效包裹疏水性药物的能力;
(3)能有效地且特异性地进入靶细胞中,将药物定点释放在病变部位;
(4)在输送药物的过程中,聚合物胶束应能避免与正常组织细胞之间的相互作用,同时保证包载药物一直具备生理活性;
(5)聚合物胶束应较快地被肾脏清除且不在正常器官(心脏,脾脏,肺叶等)内积累,以免对身体造成毒副作用。
1.3刺激响应性聚合物胶束
考虑到聚合物胶束载较差的载药能力以及非刺激性的响应特性,当载体材料进入组织细胞内,可能会致使亲水性壳包载的非亲水性药物在载癌组织内具有较差的吸收能力。响应性聚合物胶束的设计就是为了克服以上的这些困难,通过响应特殊刺激而释放载体材料中包载的药物,其中这种特殊刺激不仅包括有内部生理的,还包括了外部的刺激,如pH,还原电势,离子强度,磁场,超声波,温度,光照等[5-6]。因其具有能够响应这些刺激而迅速且精确地将药物释放在靶点处的独特优势,近年来,响应刺激而迅速释药的智能纳米系统发展良好并取得了较好的进步。接下来分别对pH敏感性、氧化还原敏感性及氧化还原/pH敏感性双响应聚合物胶束三种具有特应性响应特征的聚合物胶束来进行简单的介绍。
1.3.1 pH敏感性聚合物胶束
pH敏感性聚合物胶束可以响应所处环境pH的变换而产生相应的体积变化行为,表现为胶束粒径的变化,其在细胞内传递抗癌类药物中广泛应用。人体正常生理功能下的pH值为7.4(弱碱性),一旦pH发生变化都会破坏内环境的稳态、对正常生理功能造成影响,导致疾病或有关不良症状的发生。而肿瘤组织/细胞内由于其非正常的代谢速率而呈现一般pH值为6.5-6.8(酸性),细胞内部的一些细胞器也相应的表现出一定的酸性环境,如pH为5.5的内涵体和pH为5.0的溶酶体[7]。因此,体内细胞存在的这种不同pH环境为pH敏感性聚合物胶束创造了一个极其有利的条件,使得药物可以快速地从pH敏感性聚合物胶束中释放出来,而敏感性聚合物胶束在pH 为7.4的正常组织细胞中能保持恒定,对正常细胞无作用[8-9]。
pH敏感性纳米载体可以快速引发药物释放并发生相应的药理作用,因而,可设计这样的pH敏感性聚合物胶束,使其在pH较低的癌细胞中变得不稳定而分解释放出包载的药物,以达到高效治疗癌症的效果。
1.3.2氧化还原敏感性聚合物胶束
氧化还原敏感性聚合物胶束因其具有独特的优势而备受人们关注:(1)既可降解聚合物,如某些用于生物治疗的蛋白质、si RNA、DNA等;(2)也可实现特异性释放药物。细胞内存在浓度约0.5-10 mM的谷胱甘肽,保持一个较低的还原电势。然而,体液、细胞外基质等部位存在较低浓度约为2-20 μM的谷胱甘肽,保持着一个较高还原电势。相比较而言,细胞内的谷胱甘肽浓度比细胞外的谷胱甘肽浓度要高出约100-1000倍[10-11]。此外,癌组织细胞内的谷胱甘肽浓度比正常组织细胞内近似要高出4倍及4倍以上。因此,可以基于癌组织细胞与正常组织细胞之间的这些谷胱甘肽浓度差,来设计和制备出用于细胞内释放各种药物的氧化还原敏感性纳米颗粒[12]。可以利用这种特殊的敏感性胶束,以实现在肿瘤细胞内药物的快速及高剂量释放来抑制癌细胞,使药物有效载荷的治疗效果得到增加。
Wang等人[13]研究了由PEG-PLG和DTDP-Pt缀合而成的新型还原敏感性胶束。聚合物胶束通过二硫键实现与顺铂药物共价缀合连接到PLG链上,所得到的胶束表现出了较好控制的顺铂负载产量和还原响应性药物释放动力学,并增加了对肿瘤组织细胞的体外细胞毒性。通过在体内研究皮下人卵巢癌SKOV-3异种移植的模型,与顺铂药物相比较,由PEG-PLG与DTDP-Pt缀合合成的胶束表现出显著性的抗肿瘤活性及其低毒副作用。
1.3.3 氧化还原/pH敏感双响应聚合物胶束
除了上面介绍的pH和氧化还原敏感性单响应性聚合物纳米胶束外,在近几年,双响应性的聚合物纳米胶束同样也备受关注。相比于单响应性聚合物,双响应性聚合物能够更优地顺应复杂的生理环境,可用作一个模拟生化进程的理想平台[14]。
在Du及其同事[15]的研究工作中,他们制备了一种基于去铁蛋白(AFt)纳米笼的智能pH和ROS双重响应性药物传递系统,具有自我靶向和结合化学-光动力特征的治疗剂。此药物传递系统通过利用L-去铁蛋白受体SCARA5的特异性,来实现对4T1乳腺癌细胞的自我靶向,可以较好地避免由于靶向的化学功能化而导致纳米粒的非特异性聚集或结合等。此外,去铁蛋白AFt的特性也可被用于同时递送抗癌药阿霉素DOX和光敏剂玫瑰红RB。玫瑰红表现出了高效的活性氧ROS生成,可用于光动力治疗。同时,去铁蛋白纳米笼在被ROS氧化时,易发生肽骨架切割。因此,通过结合去铁蛋白AFt的内在pH响应性质,他们开发了一个双重ROS/pH响应系统。可通过内外部刺激的组合来控制药物释放的时间和部位,这可以避免在单一刺激响应性反应下药物不能完全释放的缺陷。在pH为5.0和激光照射条件下,药物释放率表现出显著增加,从26.1%增加到92.0%。来自去铁蛋白AFt的更多阿霉素DOX进入核内并杀死肿瘤细胞核,孵育48h后细胞的抑制率增高达到83%。
Huang及其同事[16]旨在研究一种基于PEG-BC-PGlu-ss-CPT的二嵌段共聚物的新型含酸酯键喜树碱(CPT)前药胶束,作为智能纳米系统以增强细胞摄取和实现药物的控制释放。值得注意的是,所引入硼酸酯键的目的在于实现酸触发脱PEG化及随之发生硼酸介导的增强细胞摄取。此外,CPT与前药单体通过二硫键缀合来实现对还原反应药物释放的目的。所得共聚物PEG-BC-PGlu-β-CPT在水溶液中可自组装得到近球形纳米胶束。随着pH值从7.4降低至5.0时,共聚物的降解半衰期从96.27 h急剧下降至5.7 h,表明共聚物确实具备酸降解的潜力,与尺寸粒径变化监测相对应。在pH 7.4的环境下,随着二硫苏糖醇(DTT)浓度从20 μM增加到10 mM时,前药微胶粒的CPT累积释放从8.5 %左右显著增加至82.9 %左右,表明前药微胶粒具备还原响应性的药物释放性质。当pH值从7.4降至6.0时,前药胶束对HepG 2细胞的半数抑制浓度IC50从1.06 μg/mL降至0.68 μg/mL,由此可证明硼酸酯键的参与对增强抗增殖活性有作用。更有趣的是,前药胶束对HepG 2细胞比对HL 7702细胞的细胞摄取能力更强,有力地证实硼酸介导增强了内吞作用。综上所述,这种开发的新型智能响应性前药胶束表现出作为抗肿瘤药物传递的智能纳米系统的巨大潜力。
1.3.4 聚合物胶束的应用
根据驱动胶束形成的分子间作用力的不同,可将聚合物胶束分为以下几类,包括两亲性胶束,聚离子复合性胶束以及源于金属络合而成的胶束。疏水组装的胶束通常由两亲性大分子构成,其具备相异的疏水性和亲水性构造。当两亲性聚合物胶束暴露在水溶液中,两亲性分子可以自发地自组装成超分子核/壳结构,并且可以将水不溶性药物加载到疏水核中。在胶束中,最常用的药物传送亲水性链段当属分子量为2-15 KDa的聚乙二醇(PEG),具备着无毒性、水溶性高且循环时间长等优点。除PEG外,其他聚合物包括PVP和pNIPAM也被用作胶束的亲水部分。
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: