pH响应的双药联用纳米给药系统的构建与评价毕业论文
2020-04-10 16:00:02
摘 要
柔红霉素(DNR)是一种抗肿瘤抗生素,可抑制RNA 和DNA的合成,对RNA的抑制作用最强,抗瘤谱较广,对多种肿瘤均有作用。美法仑(Mel)是一种氮芥类抗癌药物,其可以与DNA作用使DNA链发生链内或链间交联而抑制DNA的合成。由于肿瘤具有典型的复杂性和不稳定性,化疗药物单独使用作用靶点单一,很容易引起耐药性和肿瘤复发。因此肿瘤的化学治疗常采用双药联用或多药联用的方式来提高药物的治疗效果同时可降低毒副作用。
本课题采用RAFT聚合的方法制备了PPgMA共聚物,通过Cu(II)的Click反应将DNR和mPEG以化学键的形式连接在共聚物上,制备了两亲性高分子前药mPEG-PPgMA-hyd-DNR,将该前药对美法仑(Mel)包埋使其自组装形成了pH敏感性的纳米粒,DNR以及Mel可通过可酸降解的腙键水解释放出来。该双药纳米载药系统目的是提高药物治疗的有效性、协同增效,减小了药物的毒副作用。此课题主要研究了高分子载体的合成,纳米粒子的制备、纳米粒的形貌、DNR和Mel的pH敏感性释药。
关键词:纳米载药系统,高分子前药,pH敏感性,双药联用
Abstract
Daunorubicin (DNR) is an antitumor antibiotic, inhibits RNA synthesis and DNA, the strongest inhibitory effect on RNA, anti-tumor spectrum broader has effect on many kinds of cancer. Melphalan (Mel) is a kind of nitrogen mustard anticancer drugs, which can make the synthesis and DNA DNA chain or chain crosslinking between the inhibitions of DNA. Because the tumor has a typical complexity and instability of the drug alone the role of a single target, it is easy to cause drug resistance and tumor recurrence. So the chemical therapy often uses two drug combination or multi drug combined with the way to improve the therapeutic effect of drugs and reduce side effects.
This subject adopts the method of RAFT polymerization of PPgMA copolymers were synthesized by Cu (II), Click DNR and mPEG reaction in the form of chemical bond connection in the copolymer, the two amphiphilic polymeric prodrugs were prepared by mPEG-PPgMA-hyd-DNR, the prodrug of melphalan (Mel) embedded in the self-assembly the formation of nanoparticles of pH sensitivity, DNR and Mel Released by the hydrolysis of hydrazine bond acid degradation. The two drugs nano drug carrier system aims to improve the efficiency and effectiveness of collaborative drug treatments, reduce the side effects of drugs. This paper mainly studies the synthesis of polymer carrier, preparation of nanoparticles, nanoparticles morphology, DNR and Mel pH sensitive release.
Keywords: nanoparticles, polymeric prodrug, pH sensitivity, two drugs combination
目录
摘要 I
Abstract II
目录 III
第一章 绪论 1
1.1 引言 1
1.2 纳米载药系统 1
1.2.1 纳米载药系统的特点 1
1.2.2 纳米载药系统的分类 3
1.3 pH响应性纳米载药系统 4
1.3.1 pH响应性纳米载药系统的特点 4
1.3.2 pH响应性纳米载药系统的构建方法 4
1.4 双药联用纳米给药系统的构建 5
1.5 本课题的研究内容 6
第2章 mPEG-PPgMA-hyd-DNR@Mel高分子前药的制备与表征 7
2.1 引言 7
2.2 实验部分 7
2.2.1 实验仪器与材料 7
2.2.2 N3-PEG的合成 9
2.2.3 基于RAFT反应制备PPgMA 9
2.2.4 N3-hyd-DNR的合成 9
2.2.5 基于Cu(Ⅱ)的Click反应制备mPEG-PPgMA-hyd-DNR 10
2.2.6 mPEG-PPgMA-hyd-DNR@Mel的合成 10
2.2.7 红外光谱表征 11
2.2.8 1H-NMR表征 11
2.3 实验结果与讨论 11
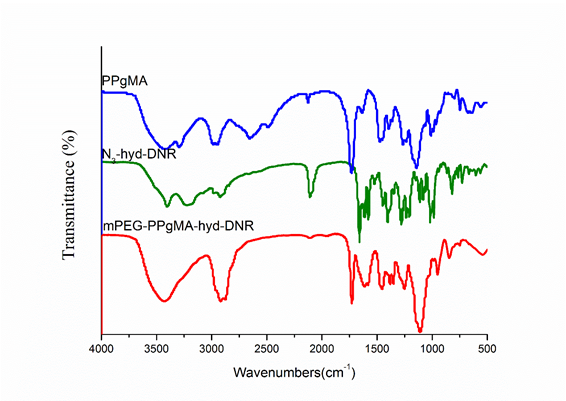
2.3.1 FT-IR图谱解析 11
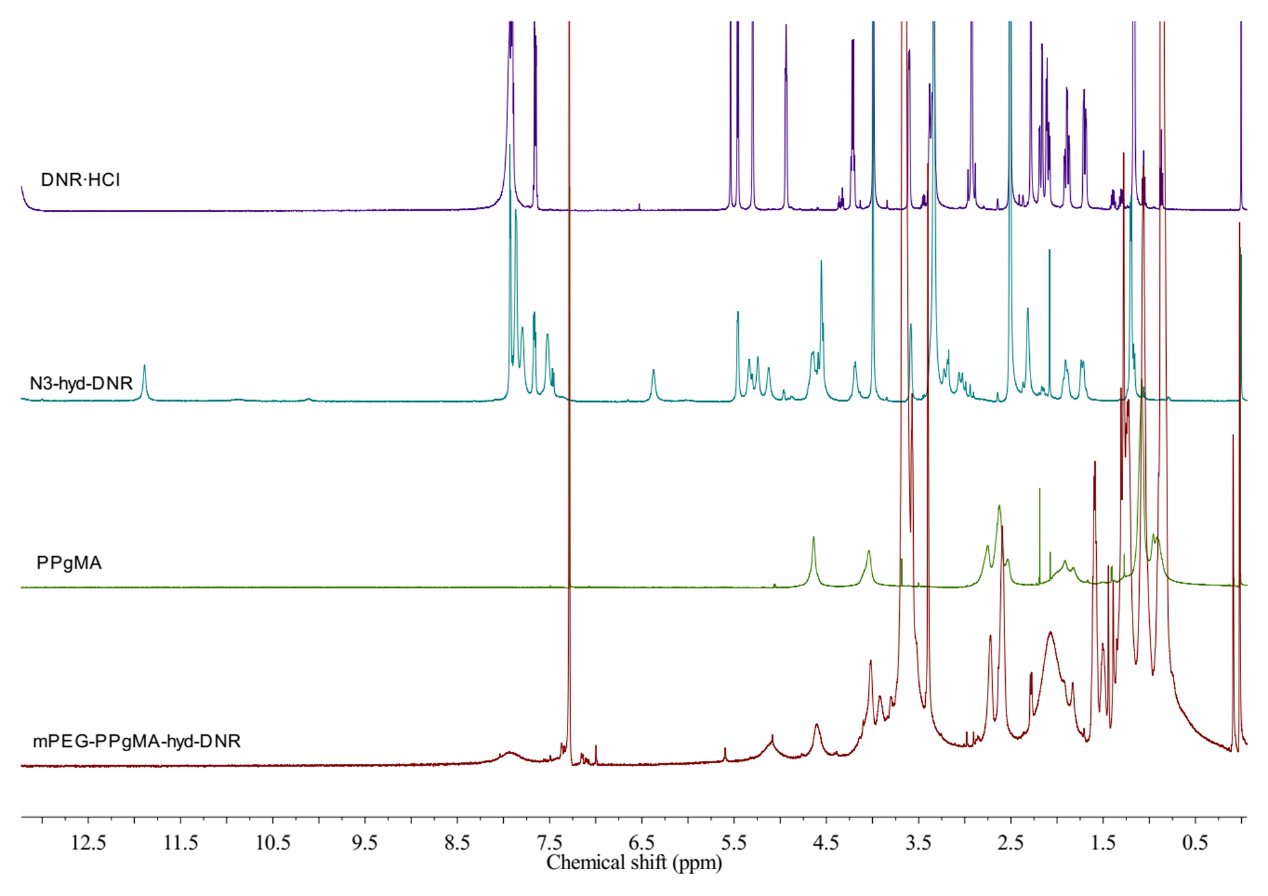
2.3.2 1H-NMR图谱解析 12
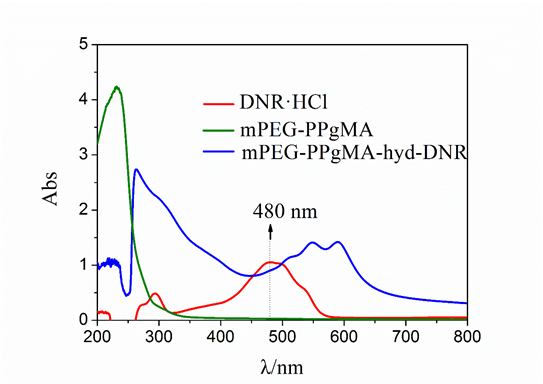
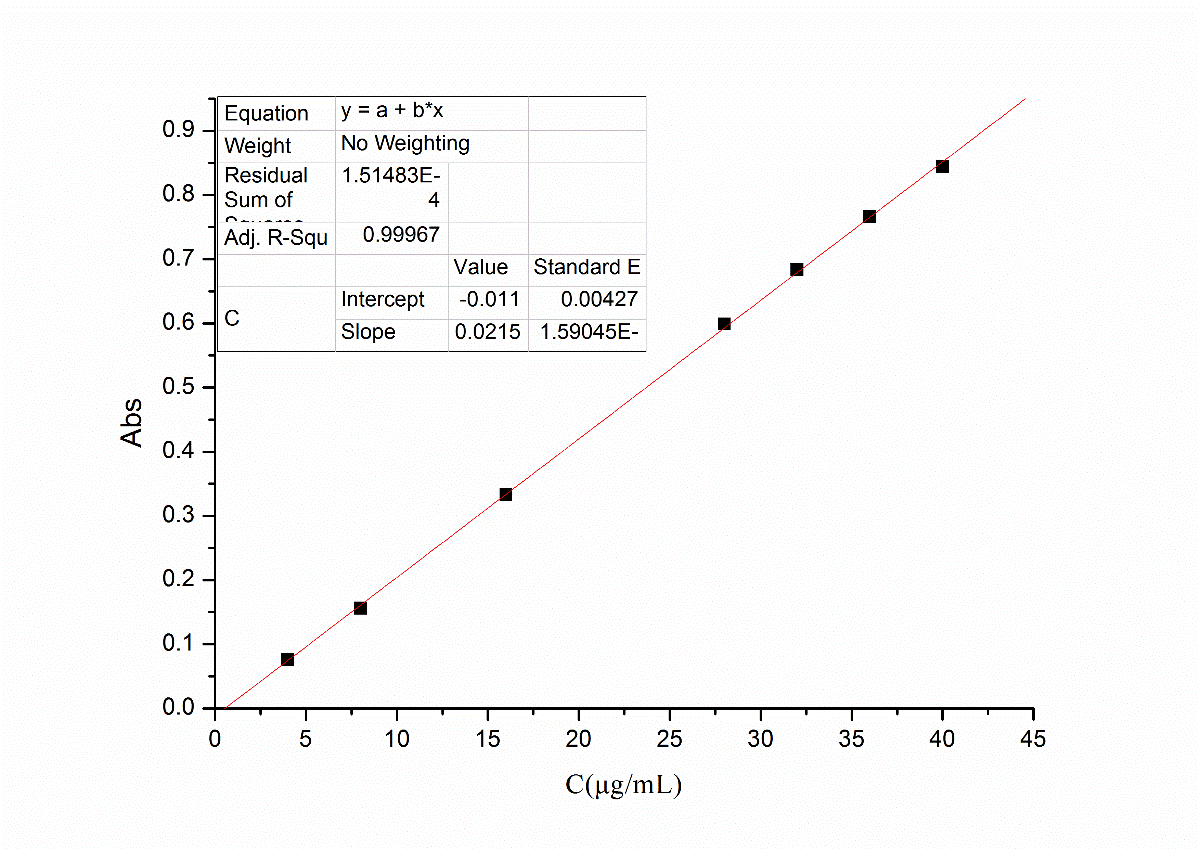
2.3.3 紫外图谱解析 12
2.4 本章小结 14
第3章 mPEG-PPgMA-hyd-DNR@Mel纳米粒制备及性能研究 15
3.1 引言 15
3.2 实验部分 15
3.2.1 实验仪器与材料 15
3.2.2 mPEG-PPgMA-hyd-DNR纳米粒的制备 16
3.2.3 mPEG-PPgMA-hyd-DNR@Mel纳米粒的制备 17
3.2.4 纳米粒的形态表征 17
3.2.5 纳米粒稳定性能研究 17
3.2.6 纳米粒体外释药行为研究 18
3.3 实验结果与讨论 19
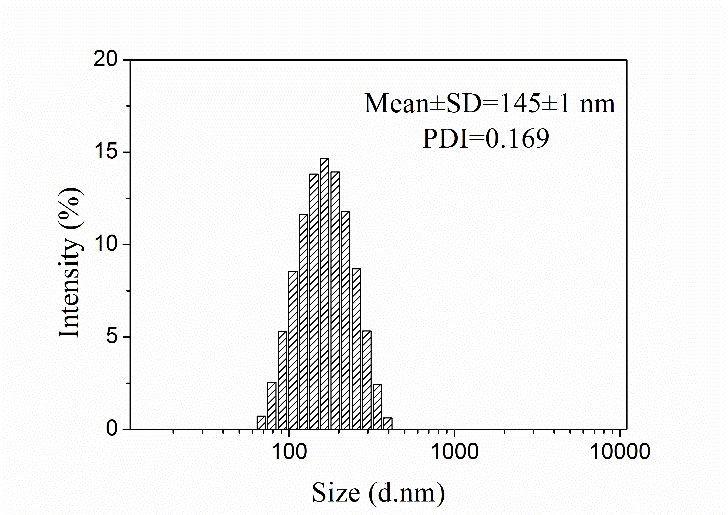
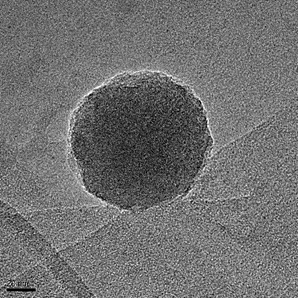
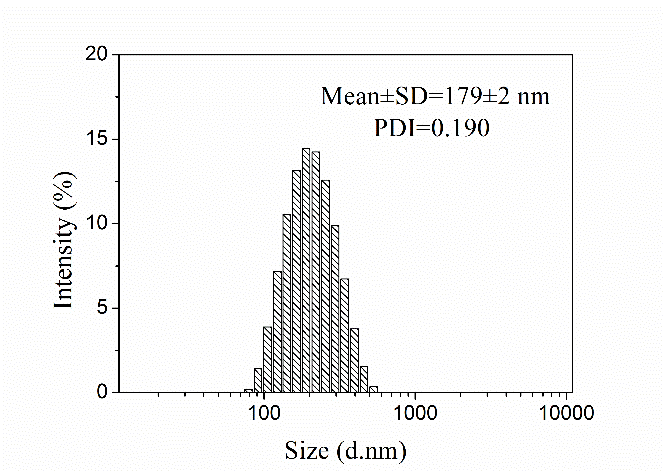
3.3.1 纳米粒形态分析 19
3.3.2 纳米粒稳定性能研究 21
3.3.3 纳米粒体外释药行为研究 21
3.4 本章小结 22
第4章 结论与展望 24
致谢 25
参考文献 26
第一章 绪论
1.1 引言
近几年来,因为癌症而导致死亡的人数越来越多。随着全球人口数量的不断增加,癌症对人类发展的负担日益加重。相关数据显示,癌症有可能会超越心血管疾病成为第一大致死因素。因此,探寻一种有效的抗癌方法或研制出有效的抗肿瘤药物成为国内外医学界研究的重要课题。
目前,癌症的治疗方法主要包括外科手术治疗、放射治疗、生物治疗以及化学药物治疗[[1]]。其中,化学药物治疗是临床应用治疗癌症最主要的方法之一,尤其适用于无法接受手术治疗以及放射治疗等其他局部治疗方法的癌症患者。化学药物治疗主要是通过抗癌药物来抑制癌细胞的繁殖和转移,从而消灭癌细胞的一种治疗方法。传统化疗方法中,抗肿瘤药物通常是通过血液循环到达病变部位以达到杀死癌细胞的目的。但是由于一般药物无法特异性识别癌细胞和正常细胞,所以药物在杀死癌细胞的同时,也会对正常细胞造成一定的损害,对人体有较大的毒副作用[[2]]。同时,只有少量药物可以通过血液循环到达病变部位,生物利用度较低,所以需要多次给药才能达到治疗所需的血药浓度,容易引起耐药性,增加药物的毒性反应,从而增加癌症治疗的难度。通过纳米技术制备的药物具备治疗效果显著、稳定性好,选择性高、毒副作用低等显著优势,被广泛的应用于各种肿瘤的治疗。研究表明,通过纳米技术将化疗药物进行包埋,连接之后可以在降低毒副作用的同时有效地提高药物对肿瘤细胞的特异性识别,纳米给药系统的构建成为现在的研究热点。
在临床应用中,单独使用一种抗肿瘤药物作用部位比较单一,治疗效果不是很理想。随着抗肿瘤药物研究领域的发展,双药联用的治疗方法不仅可以减少药物的毒副作用,还可以有效增加治疗效果,得到了医学界广泛认可。
1.2 纳米载药系统
纳米载药系统(Nano Drug Delivery System, NDDS),是指采用共价偶联的化学手段或者包埋、吸附等物理手段将小分子天然药物与天然、合成的载体分子整合在一起,制备成有纳米尺寸的药物传递系统。研究发现,将纳米技术应用于药物传输而构建的纳米载药系统,不仅能够特异性识别病灶部位,还可实现药物的控制性释放,因而极大地提高了药物的生物利用度,并有效减少了系统毒性[[3]]。
1.2.1 纳米载药系统的特点
纳米载药系统之所以能够引起如此众多关注,主要原因是:与其他药物传递系统相比较,纳米载药系统具有特别的化学和物理性质,使其在药物传递方面有非常显著的优势。
1.2.1.1 靶向特性
纳米载药系统具有靶向特性,能够定向的将药物输送到病灶部位,降低正常组织及细胞对药物的摄取量,减少系统毒性,且有效的提高了药物的生物利用度。纳米载药系统的靶向性包含主动靶向和被动靶向。
主动靶向是指采用物理、化学或生物方法将药物导入病灶部位,针对病变细胞进行定向治疗。与正常细胞相比,肿瘤细胞表面一般会特异性地高表达某些分子,所以能够采用能与肿瘤细胞表面分子特异性结合的配体修饰纳米粒,使纳米粒能特异性识别肿瘤细胞,从而实现药物的主动靶向传输,达到提高抗肿瘤的效果。
被动靶向是指由于肿瘤组织、细胞的物理化学或者外在药物因素,使得载药系统具有在病灶部位聚集的特点,主要包括肿瘤微环境(Tumor Microenvironment)靶向和EPR(Enhanced Permeability and Retention)靶向。
1.2.1.2 表面多功能性
纳米载药系统拥有较大的比表面积,通过对纳米颗粒表面进行修饰,可以实现纳米颗粒的多功能性,从而大大提高肿瘤治疗的效率。在纳米颗粒的表面修饰中,PEG修饰是较为常用的一种功能化方法。用PEG对纳米粒表面进行修饰,能够有效地防止其被细胞吞噬,延长纳米粒在血液循环中的循环时间。
1.2.1.3 尺寸优势
纳米载药系统最为显著的优势在于它是一种具有纳米尺寸的小颗粒。通常认为,纳米载药系统的粒径在10-1000 nm范围内[[4]]。纳米载药系统合适尺寸的关键在于其形式上适合生物技术的需要,而并不限定于10-1000 nm。纳米载药系统的尺寸可能与多肽、蛋白质、或核酸等体内生物大分子相当,并且远远小于肿瘤细胞的大小。由于其尺寸小,纳米粒子比微米粒子能负载更多的药物分子进入细胞,并且细胞摄取存在显著的增强。此外,纳米药物在细胞外介质中能与生物分子互相作用,从而干扰肿瘤细胞的生存和增值。
1.2.1.4 改善传统化疗药物缺陷
传统化疗药物存在着许多缺陷,而纳米载药系统能有效的改进传统化疗药物存在的这些缺陷:
(1)实现药物的控制释放。纳米载药系统能够通过调整载体药物的类别、配比等各种参数,来实现药物的控制性释放。
(2)提高药物稳定性。纳米载药系统将化疗药物包裹在疏水内核,为药物提供一个稳定的储存空间,有效地避免其在血液循环中发生降解或者失活,从而保障药物的生物活性。
(3)提高药物生物利用度。由于纳米粒表面积巨大且高度分散,有效地增加了药物与病灶部位生物膜接触的面积[[5]]。同时,药物包裹在纳米粒内,可明显增加药物在血液循环中的时间,从而提高生物利用度。
(4)增加药物溶解性。纳米载药系统将疏水性化疗药物通过物理或化学键合包裹在纳米粒内,可以有效地增加药物的溶解性,从而加快肿瘤细胞对药物分子的摄取[[6]]。
1.2.2 纳米载药系统的分类
目前,用于抗癌药物传输的纳米载药系统种类非常之多,依据载体材料的类型,可大概分为三类:基于聚合物类纳米颗粒(Polymer-based Nanoparticles)、基于脂质体类纳米颗粒(Lipid-based Nanoparticles)和无机纳米颗粒(Inorganic Nanoparticles)。
1.2.2.1 基于脂质体类纳米颗粒
脂质体类纳米颗粒通常是采用天然或人工合成的类脂为载体。由于类脂材料具有如同人类细胞膜磷脂双分子层的结构,具有良好的生物相容性,因而该系统可同时携带亲水性和疏水性的药物分子,亲水性药物装载在脂质体内,疏水性药物则装载在磷脂双分子层之间[[7]]。此外,还可将药物分子通过吸附作用结合在纳米颗粒表面,纳米颗粒通过吸附、融合等方式透过肿瘤细胞膜而将药物传递到肿瘤细胞内,从而提高药物生物利用度。基于脂质体类的纳米颗粒种类较多,主要包括脂质体(Liposome)、固体脂质纳米粒(Solid Lipid Nanoparticles, SLN)、微乳(Microemulsion)等[[8]]。
1.2.2.2 无机纳米颗粒
无机纳米颗粒制备简单,具备良好尺寸及形状可控性,同时由于无机材料具有独特的光、电、磁等性质,使得无机纳米颗粒的应用非常广泛,不仅可用于药物传输,同时还可用作肿瘤成像以及肿瘤靶向治疗等[[9]]。常见的无机纳米颗粒包括:磁性纳米颗粒、介孔二氧化硅纳米颗粒、碳纳米颗粒、金纳米颗粒等。
1.2.2.3 基于聚合物类纳米颗粒
聚合物类纳米颗粒是以聚合物材料作为载体而构建的药物载药系统。由于大多数聚合物材料具有良好的生物可降解性和生物相容性,因此非常适合作为药物传输的载体。根据聚合物载体材料的组成以及载体的结构可以分为聚合物胶束、聚合物纳米粒子和聚合物囊泡三种[[10]]。本文主要对聚合物胶束做简单的介绍。
聚合物胶束,是由两亲性聚合物在水介质中经过自组装形成的具备“核-壳”结构的纳米颗粒[[11]]。通过化学键合或者物理包埋的方法将难溶性药物包裹在聚合物胶束核心,不仅能增加药物的溶解性,同时还能降低药物对正常组织细胞的毒副作用。同时,亲水性外壳隔绝了内核中的药物与生物媒介,能够有效避免蛋白的吸附以及胞内粘附,避免了网状内皮系统对药物的非特异性摄取或肝、脾对药物的吸收,使药物能在血液系统中长时间循环,提高了药物的生物利用度。除此之外,聚合物胶束还具有其他很多优点:①聚合物胶束的自组装过程简单且易于控制,同时其结构在体内外都具有较高稳定性,易于保存;②具有EPR效应,使药物在病灶部位富集;③具有较低的临界胶束浓度和较好的热力学和动力学稳定性;④疏水性内核可包裹较多疏水性药物,载药量较高,有效增加到达病灶部位的药物含量,从而提高肿瘤的治疗效果。
1.3 pH响应性纳米载药系统
pH响应性纳米载药系统,是指借助人体环境天然存在的肿瘤细胞与正常细胞的pH差异,构建出的对肿瘤细胞微酸环境特异性响应的载药体系,可在血液循环过程中保持稳定,而受到肿瘤细胞pH值的影响后会发生电荷解离或化学键断裂的现象,从而释放药物分子,达到靶向释药的效果,同时可降低系统毒性并提高抗肿瘤效果。
1.3.1 pH响应性纳米载药系统的特点
pH响应型纳米载药系统主要是依据人体内不同组织和细胞器的pH差异制备的。由于肿瘤细胞无法正常调控细胞的生长,导致肿瘤细胞代谢速率高于正常细胞,代谢产生的乳酸无法及时排出,使得肿瘤微环境的pH范围是6.0~7.0。而血液的pH为7.4,内含体/溶酶体pH为4.5~6.5[[12]]。
pH响应性纳米载药系统的主要特点是在酸性条件下其含有的可电离部分能够发生质子化反应,引起抗肿瘤药物的敏感释放,加快载药粒子与膜蛋白发生特异性结合,避免了细胞的排斥反应,到达病灶部位控释抗肿瘤药物[[13]]。pH响应性纳米载药系统解决了药物在血液循环中提前渗漏的问题,增加肿瘤部位药物的有效胞内浓度,可以高效杀死肿瘤细胞11。
1.3.2 pH响应性纳米载药系统的构建方法
目前研究较多的pH响应型载药系统主要分为两种,一种是引入“可电离”的聚合物,另一种是引入pH敏感性的化学键。
1.3.2.1 引入“可电离”的聚合物
“可电离”的聚合物具有特定的酸离解常数(pKa值),当环境pH值在聚合物pKa值附近变化时,会导致聚合物链的质子化/去质子化的平衡发生改变,聚合物的溶解性也随之发生改变,从而释放出药物[[14]]。
“可电离”的聚合物[[15]]主要有阴离子聚合物和阳离子聚合物。阴离子聚合物通常含有弱酸基团(一般为羧酸或磺酸),在酸性条件下不易发生电离,具有疏水性,聚合物自发聚集,形成胶束,而在中性或碱性条件下弱酸基团电离成酸负离子,溶解性增强,聚合物由不溶于水变为易溶,胶束结构被破坏[[16]]。其中常见弱酸基团的pH响应性聚合物包括聚丙烯酸(PAA)、聚甲基丙烯酸(PMAA)、聚乙基丙烯酸(PEAA)、聚谷氨酸(PGA)和磺酸基团等[[17]]。在中或碱性条件下,含有氨基的阳离子聚合物未质子化,从而具有疏水性,更易形成胶束结构;而在酸性条件,聚合物质子化,疏水端变的易溶于水,胶束结构被破坏。常见的具有pH响应性的阳离子聚合物除了含有吡啶基、咪唑基团的聚合物外,还包括含有氨基的聚乙烯吡咯烷酮(PVP)、聚组氨酸(PHis)、聚甲基丙烯酸N,N-二甲氨基乙酯(PDMAEMA)、聚甲基丙烯酸N,N-二乙氨基乙酯(PDEAEMA)、壳聚糖(CS)、聚β-氨基酯(PAE)等[[18]]。
1.3.2.2 引入pH敏感性化学键
pH敏感性化学键主要有腙键、缩醛(酮)、亚胺键、原酸酯键、顺式乌头酸酐等。引入pH敏感性化学键通常有两种方法,一种是在在载体聚合物分子链上引入pH敏感性化学键,然后包裹药物,形成纳米系统,在弱酸性条件下,化学键断裂,纳米结构破坏,从而释放药物;另一种是将药物与聚合物载体直接通过pH敏感性化学键连接,形成两亲性聚合物,于水介质中自发形成纳米粒,在酸性条件下,化学键断裂,纳米结构降解,从而释放药物[[19]]。本研究主要是采用第二种方式:将药物柔红霉素与聚合物载体甲氧基聚乙二醇直接通过pH敏感性化学键腙键连接,形成两亲性聚合物。
腙键是研究较多的pH响应性化学键,通常是由羰基与肼基反应所得,含有C=N-N结构。腙键在生理pH条件下非常稳定,在酸性条件下易发生水解。腙键已经成功地用于多种药物传输。同时除了在聚合物-药物系统中充当连接基团,腙键也被应用于无机纳米材料-药物偶联物中。研究表明,用腙键进行偶联构建出的pH响应的纳米载药系统。的酸敏感性能够有效地促进药物在肿瘤干细胞中释放。
1.4 双药联用纳米给药系统的构建
由于肿瘤具有典型的复杂性和不稳定性,化疗药物单独使用作用靶点单一,作用效果有限,生物利用度较低,很容易引起耐药性和肿瘤复发[[20]]。为了满足临床治疗的需求,肿瘤的化学治疗常采用双药联用或多药联用的方式来提高药物的治疗效果和生物利用度。本课题主要是研究柔红霉素和美法仑的双药联用给药系统的构建及效果。
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: