生物质热解制备燃料电池催化剂对氧还原催化性能影响的实验研究毕业论文
2020-02-19 09:08:50
摘 要
如今能源与环境的双重危机影响人类社会的进步与发展,发展清洁能源技术刻不容缓,燃料电池作为一种新型的清洁能源技术重新受到人们的关注,但是由于需要昂贵的Pt基催化剂去提高电池反应速率,一直阻碍着燃料电池的大规模商业化利用。本文将废弃的生物质(竹子)高值化利用,掺杂铁、钴800℃热解制备介孔碳载体,再掺杂三聚氰胺二次热解(850℃)制备M-N-C(M为非贵金属)ORR催化剂。结果表明:所制备的催化剂BaFeN-850℃起始还原电位和半波电位上分别为0.98V和0.85V,极限电流密度为5.35mAcm-2;经过40000s的持续放电测试后,电流密度仍有最初的92%,稳定性高于商业化20wt%Pt/C的89.6%,而且甲醇耐受性也优于商业化20wt%Pt/C。本论文的研究对生物质高值化利用制备燃料电池催化剂提供指导意义,对燃料电池大规模应用具有促进作用。
关键词:燃料电池;生物质;介孔碳;铂;铁
abstract
Nowadays, the dual crises of energy and environment affect the progress and development of human society. It is urgent to develop clean energy technology. Fuel cell, as a new clean energy technology, has attracted renewed attention. However, the large-scale commercial use of fuel cell has been hindered by the need for expensive Pt-based catalysts to improve the reaction rate of the battery. In this paper, waste biomass (bamboo) was used to prepare mesoporous carbon carriers by pyrolysis at 800℃ doped with iron and cobalt, and then the ORR catalyst M-N-C (M is a non-noble metal) was prepared by secondary pyrolysis of melamine (850℃). The results showed that the initial reduction potential and half-wave potential of the prepared catalyst were 0.98V and 0.85V, respectively, and the limiting current density was 5.35mAcm-2. After continuous discharge test for 40000s, the current density was still 92% initially, and the stability was higher than 89.6% of commercialized 20wt% Pt/C, and the methanol tolerance was also better than that of commercialized 20wt% Pt/C. The research in this paper provides guidance for the preparation of fuel cell catalysts for high-value utilization of biomass, and promotes the large-scale application of fuel cells.
Key words: fuel cell; biomass; mesoporous carbon; platinum; iron
目录
第1章 绪论 1
1.1引言 1
1.2 燃料电池概述 1
1.3 燃料电池的分类 2
1.3.1质子交换膜燃料电池 3
1.4燃料电池催化剂 3
1.4.1 Pt基催化剂的改进 4
1.4.2 非贵金属催化剂的研究 4
1.5生物质基碳材料 5
1.5.1生物质 5
1.5.2生物质的综合利用 6
1.6 课题研究的背景与意义 7
1.7课题研究内容 8
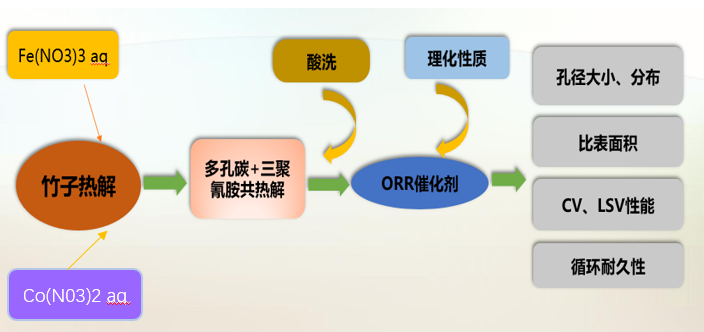
第二章 ORR催化剂的制备 9
2.1实验方案 9
2.1.1实验原料 9
2.2方案设计与具体操作 9
2.2.1实验方案的设计 9
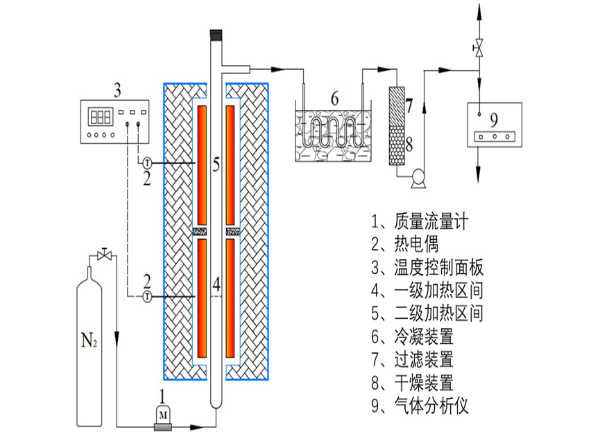
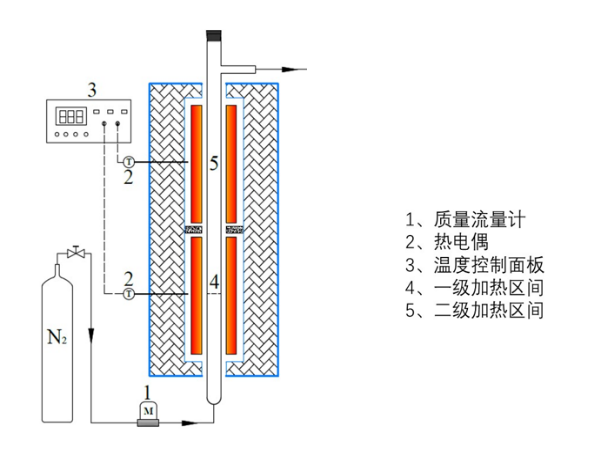
2.2.2实验方案的装置 10
2.2.3实验方案的具体操作 11
2.3本章小结 11
第三章 ORR催化剂的表征 12
3.1物理性质的表征 12
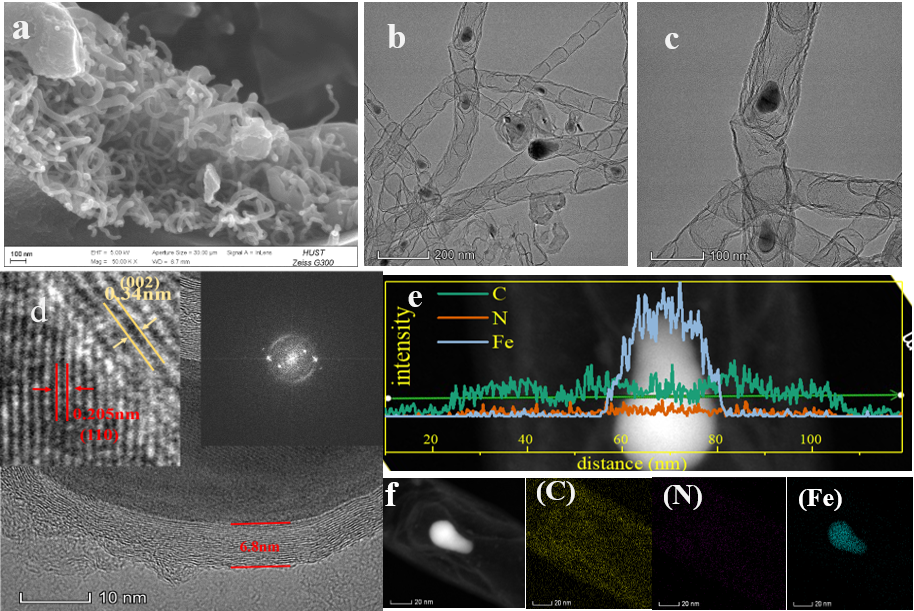
3.1.1 SEM、TEM的分析 12
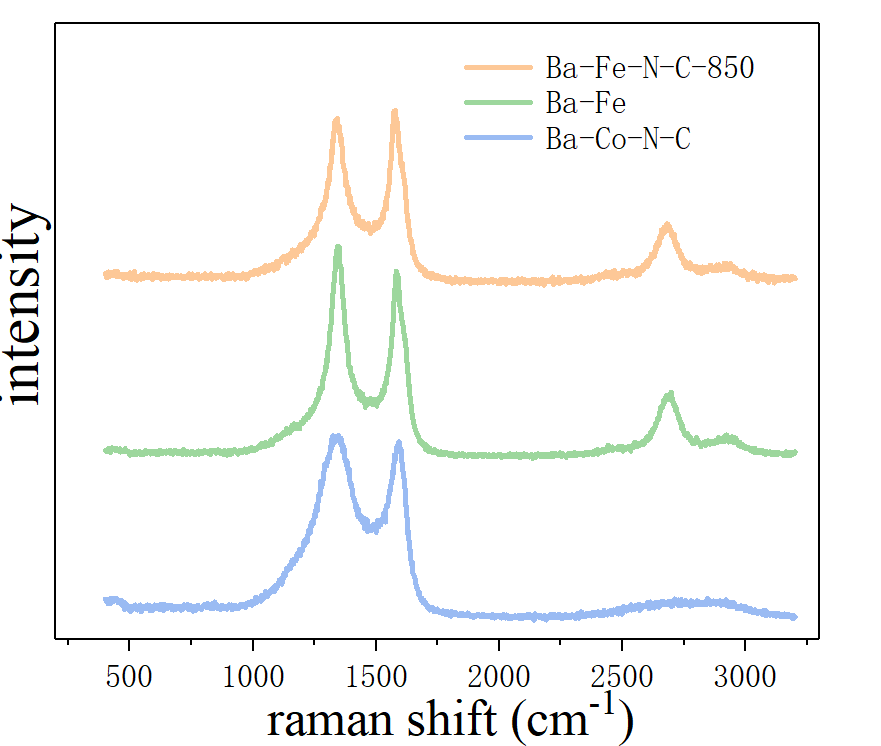
3.1.2 拉曼数据分析 13
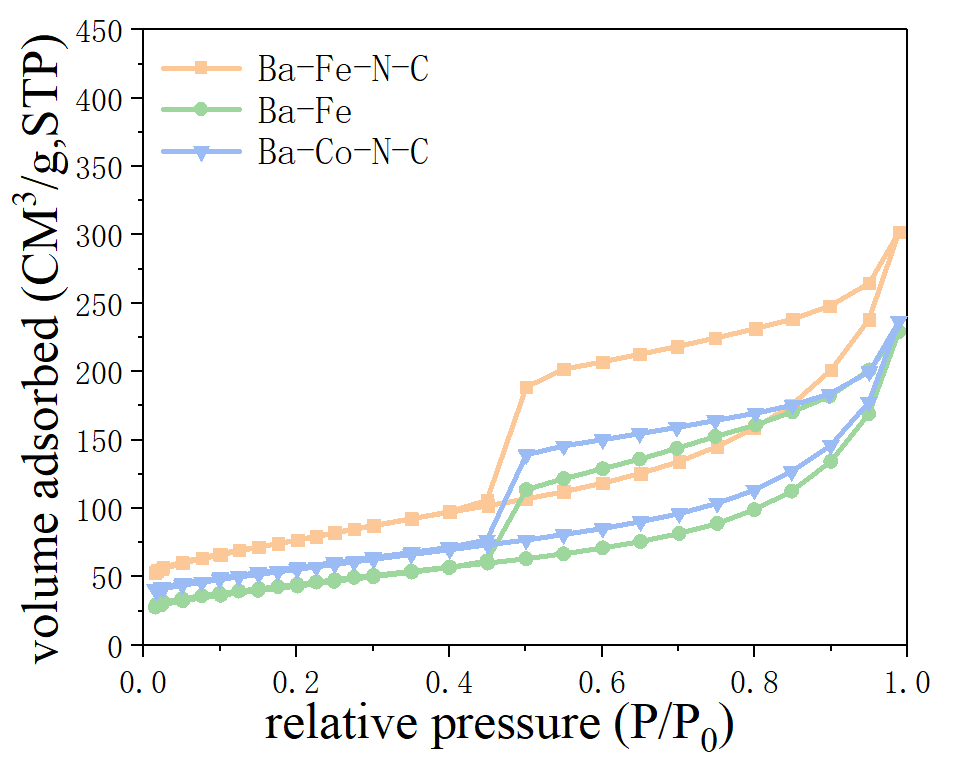
3.1.3 BET数据分析 13
3.2化学性质的表征 14
3.2.1 XRD分析 14
3.2.2 XPS分析 15
3.3电化学性质的表征 17
3.4本章小结 20
第四章 总结与展望 21
4.1总 结 21
4.2展 望 22
致 谢 24
参考文献 25
第1章 绪论
1.1引言
随着社会文明的不断进步,人类与能源的关系日益密切。能源在保障我们生存的同时,我们对于能源的消耗也日益增加。煤、石油等化石燃料具有储量不足、分布不均、不可再生、燃烧产物危害环境等缺陷,所以随着人类大量的开采与利用,能源与环境危机已经成为影响当今社会进步与发展的双重阻碍[1]。为了实现能源的可持续利用,发展能源的可再生和可持续转换技术,开发绿色与经济的清洁能源来代替化石燃料具有极其重要的意义[2]。
燃料电池是一种新型的清洁能源转换技术,与传统能源转换方式相比,它是不经过燃烧将化学能直接转化为电能,所以其具有能量转换密度高和环境友好等优点[3]。燃料电池阴极主要发生氧还原反应(Oxygen reduction reaction,ORR),但其反应动力学缓慢,目前主要使用铂(Pt)基贵金属催化剂去提高阴极反应速率。但其储量不足、价格昂贵、甲醇耐受性低以及容易CO中毒导致其无法在生产生活中大规模运用。
阴极催化剂限制了燃料电池在全球范围内的大规模使用,因此降低Pt基催化剂的生产成本与简化制备方法或者发展催化活性、稳定性和耐久性高的非Pt基催化剂都具有广泛的研究前景,对于燃料电池的规模化应用也具有极大的促进作用。
1.2 燃料电池概述
燃料电池是除地热能、太阳能、风能、潮汐能等以外的一种清洁能源发电方式。它实际上就是将燃料的化学能转化成电能的化学装置,由阳极、阴极、电解液三部分组成,阳极主要输入液体或气体燃料(H2、CH4、CH3OH等),阴极通常由氧气或者空气作为氧化剂[4] [5]。燃料在阳极发生氧化反应失电子,阴极氧化剂得电子发生还原反应,所以燃料电池实际上就是由两个相对独立的氧化和还原反应组成[6]。相比于普通电池,它通过源源不断的输入燃料与氧化剂,从而可以持续对外放电。
19世纪是燃料电池开始的时期,目前为止谁最先发现燃料电池仍然存在很大争议。有人认为是1838年德国化学家Christian Friedric Schönbein最先发现燃料电池。也有人坚信是William Robert Grove首次提出燃料电池的概念,Grove将双铂电极的一端浸入硫酸溶液中,另一端分别密封在氧气和氢气的容器中,发现两电极间会产生恒定电流[3]。1933年初,由于Thomas Francis Bacon的研究使得燃料电池的发展达到成熟,Bacon制作出第一个能够实际应用的氢氧燃料电池,将氢气和氧气通过电化学过程转化成电能。在二十世纪六十年代早期,大家的注意力主要集中在酸性电解质燃料电池和Pt基催化剂。目前燃料电池在飞机、船舶、汽车等交通和军事领域有着较为广泛的运用,另外燃料电池系统在商场、医院等公共场所也在推广使用。燃料电池现在已经渗透到我们生活的方方面面。
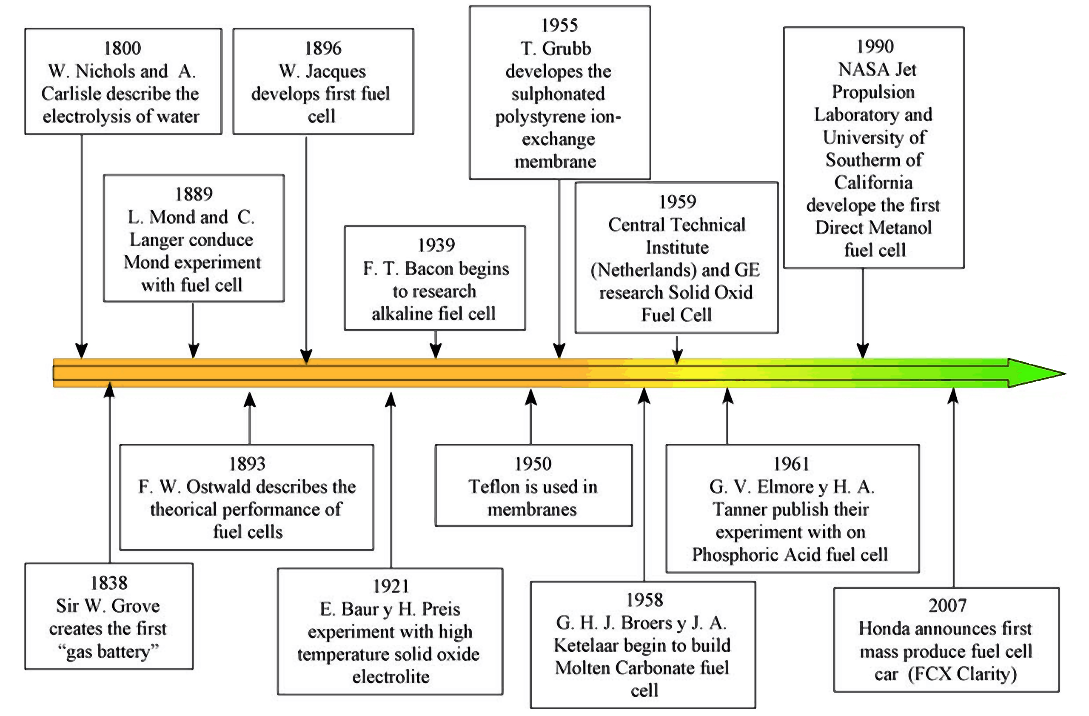
图1-1 燃料电池的发展历程
相比于传统能源转换方式和目前其他的能源装置,燃料电池具有很多突出的优势:1.反应过程不经过燃烧也不受卡诺循环的限制,既减少了热量损耗,又直接将化学能转化成电能,能量转换效率高,理论可达85%以上;2.反应产物不会生成传统化石燃料排放的氮氧化物、硫氧化物等环境污染物,CH4、CH3OH作为燃料产生的CO2排放比发电厂也少35%以上,若氢气作为燃料,则产物为水,对环境友好;3.燃料电池组成简单,规模可由实际需求来进行调整,燃料适用性广,反应过程安静,不会产生噪声污染[4]。正是由于拥有如此之多的优点,燃料电池才会受到世界各国的广泛关注与众多研究者的潜心探索。
1.3 燃料电池的分类
燃料电池的分类方式复杂多样,目前人们习惯按照其工作温度、燃料来源和电解质的不同将其分门归类[3] [7]。
表1-1 燃料电池分类

随着技术的发展,氢气和甲醇的制取工艺变得简单,价格也更加的便宜以及质子交换膜电池产生的污染小、环境友好、运行快且噪音小,所以在军事、交通等领域已经在逐步推广使用。
1.3.1质子交换膜燃料电池
质子交换膜燃料电池以清洁能源氢气或甲醇作为阳极燃料,空气或者氧气作为阴极氧化剂,主要使用Pt基催化剂[8]。燃料在催化剂的表面催化作用下发生氧化反应,失去电子和产生H , H 通过质子交换膜与阴极的氧气结合发生还原反应生成水,从反应过程及产物上看,质子交换膜电池反应条件低、反应过程比较平缓噪音小、反应产物对空气基本上无污染,理论上只要阳极持续输入氢气或甲醇,就能一直对外供能[9]。当然跟其他类型的燃料电池相同,质子交换膜电池阴极反应活性低,反应速率慢,目前通常在阴极和阳极使用Pt基催化剂来提高反应效率。
质子交换膜燃料电池与其他燃料电池相比较具有明显的便捷、迅速、污染小等优势,在汽车、火车等交通运输中有较为广泛的使用,也具有商业利用的发展前景。质子交换膜燃料电池的研究与发现对于发展新型清洁能源来说既是机遇也是挑战。1.阴极和阳极使用的Pt基催化剂价格昂贵,对于燃料电池制备成本来说是一笔巨大的投入;2. Pt基催化剂长期在电解液环境中易溶解,性能会降低,另外催化剂不耐受甲醇,所以在甲醇作为燃料的电池中极易失活;3.质子交换膜易降解,丧失选择通过性的能力。
众多研究者致力于降低催化剂的制备成本和提高催化剂的活性及稳定性,设计不易降解、稳定性及选择性高的质子交换膜。降低电池的生产成本、提高电池的耐久性对于今后规模化运用清洁能源(氢气、甲醇),减少大气污染具有重大意义。
1.4燃料电池催化剂
目前为止Pt基催化剂在燃料电池中运用范围最广泛,得益于它不管是酸性还是碱性环境中都具有较好的催化活性,能降低反应的活化能,大幅度提高燃料电池反应速率。当然由于Pt储量稀少,作为催化剂材料使得燃料电池成本一直居高不下,据统计仅Pt基催化剂就占燃料电池成本的1/4[10]。当然除了价格的原因,Pt基催化剂容易中毒以及在强酸环境中稳定性降低等问题也阻碍了它商业化应用:
- CO中毒:Pt基催化剂与阴极氧化物氧气的结合能力不是很强,但是对于空气中的CO吸附能力却很强,这就导致CO易于吸附在Pt的表面,占据活性位点的位置,使催化剂中毒和丧失了催化活性[11]。
- 甲醇耐受性低:甲醇氧化会生成中间体CO,因为Pt基催化剂容易CO中毒,所以在甲醇燃料电池中极易失活。
- 强酸环境中稳定性降低:在强酸环境中,由于催化氧还原条件比较严格,需要比较高的过电位,Pt基催化剂不耐受这样的环境,容易发生Pt溶解和碳材料被氧化的问题。
可以看出Pt碳催化剂存在以上种种缺陷,所以即使其具有优异的催化氧还原的能力,也无法使燃料电池投入大规模的生产生活中去使用,因此尽可能减少Pt的使用量或者发展无Pt非贵金属催化剂对于燃料电池的推广与使用具有重大意义。
1.4.1 Pt基催化剂的改进
对于Pt基催化剂来说,我们在不降低其原有的催化活性基础上,减少Pt金属的使用成本以及提高其抗中毒性和稳定性是大家研究的重点,目前为止研究者主要通过调控Pt金属的颗粒尺寸及晶面方向、掺杂其他金属形成合金或者核壳结构、对Pt金属颗粒表面进行改性、使用耐腐蚀性强且与Pt配合良好的载体材料:
- 调控Pt金属颗粒的尺寸及晶面方向:一般来说,活性位点主要位于表面Pt上,所以我们使用颗粒细小的Pt金属均匀分散在燃料电池阴极表面,既避免了Pt颗粒聚集成团导致活性降低,又减少了Pt的使用量;对于Pt金属来说不同的晶面对于ORR催化活性的能力是不同的,研究发现单晶Pt在HCLO4电解液中,Pt(110)效果最好[12]。所以我们去探究和展现催化活性最好的晶面在催化剂中。
- 掺杂其他金属:研究发现Pt与另外一种非贵金属形成合金结构的催化剂,例如Pt与Cu、Ni、Co等金属制成的双金属催化剂,其ORR性能明显优于纯Pt,且成本大大降低;与非贵金属形成核壳结构,Pt作为表层外壳来包覆内核非贵金属,因为主要是表层的Pt起催化活性,所以这样的结构既暴露了更多的活性位点面积,又用非贵金属代替内核Pt大大减少了Pt的使用量。
- 对Pt金属颗粒表面进行改性:用分子、离子等物种对Pt表面进行修饰改性,可有效提高催化剂的活性或者稳定性,还可以使催化剂增加一些特定的性能(如亲水性)[3] [13]。研究发现在Pt的表面修饰少量Si层能明显改善其在高的过电位情况下易发生聚集溶解的情况。
- 使用耐腐蚀性强且与Pt配合良好的载体材料:目前常用的载体主要是碳材料,主要是因为其具有发达孔隙结构、丰富的比表面积、良好的化学和热稳定性[14] [15]。碳纳米管、石墨烯、多孔碳等碳材料与Pt配合能够促进电子传递,提高ORR催化活性,还因为其能够提供丰富的比表面积从而降低Pt的使用量。碳材料的这些优势作为Pt基催化剂载体对于提高催化活性和降低催化剂价格有显著提升。
1.4.2 非贵金属催化剂的研究
为了进一步降低催化剂生产成本以及实现催化剂的可持续利用,研究者将目光投向了非贵金属,大部分非贵金属催化剂在碱性环境中ORR性能与Pt基催化剂相当,但在酸性电解液环境中表现却不尽如人意。在1989年,Yeager等人发现Fe、Co分别与含N的聚合物配位并以碳作为载体制备的非贵金属催化剂具有理想的催化活性,并在后续深入研究后提出M-N-C(过渡金属-氮-碳化合物)模型,当催化剂中同时含有这三种元素时,表现出令人惊喜的活性与稳定性。在此基础上,Peng等人选择用过渡金属分别掺氮去合成M-N-C催化剂,实验发现Fe-N-C的催化活性最高,Co-N-C的催化活性次之。最新的研究发现,Liu等人制备了Fe、Co双金属嵌入掺杂氮的石墨烯载体的催化剂,其ORR催化性能高于单金属催化剂和接近Pt基催化剂,其出色的循环使用耐久性远高于Pt基催化剂[2]。因为Fe-N-C和Co-N-C类催化剂不管在酸性还是碱性电解液环境中都展现出优越的催化活性且具有杰出的稳定性,所以研究者投入了大量的精力去研究性能更优、价格更廉的单金属或多金属催化剂,希望能早日替代Pt基催化剂投入使用。
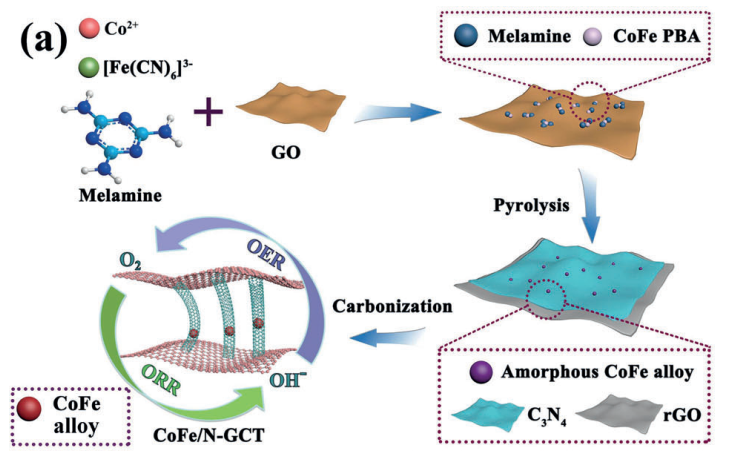
图1-2 石墨烯载体的FeCo双金属催化剂
1.5生物质基碳材料
1.5.1生物质
据国际能源署(IEA)规定,生物质是进行光合作用进而形成的的各种生物体,所有植物和动物以及微生物都属于生物质的范畴[16]。它们将太阳能转化成化学能储存在体内这就形成了生物质能,因此其具有循环可再生性。植物的光合作用按照下列方式进行:
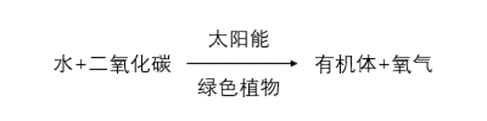
生物质作为唯一的含碳的可再生能源,从能量转换形式上来看,不同于传统化石燃料会产生大量温室气体,生物质能在生成过程中会吸收空气中的CO2,并产生氧气,所以生物质能在利用的过程中基本上不排放CO2。生物质相比于煤、石油等化石燃料其含S量很少,所以排放的SOX类气体量对环境的污染几乎没有[17] [18]。
![C:\Users\淑娟\AppData\Roaming\Tencent\Users\457827274\QQ\WinTemp\RichOle\UO(FYD2F@UUI8}P%]JXHZ`0.png](http://www.biyelunwen.org/wp-content/uploads/2020/02/lw4152_20202199847859.png)
图1-3生物质组成与应用示意图
 生物质能作为一种污染小、可循环利用的新型能源,各国在大力推进新能源发展战略时将生物质列为能源领域重要研究方向,并将研究和开发生物质能放在首要位置。我国的生物质资源丰富并且数量巨大。在2007年,对生物质产量的统计数据结果显示,以产能计算,测得中国年产生物质能相当于9.3×109吨标准煤,其中的农林废弃物可提供相当于3.8×109吨标准煤的能量。据统计, 我国农作物秸秆可采集量约为4.5×109吨/年,折合相当于标准煤 1.8×109吨;稻壳5×107吨,折合标准煤2×107吨;林业加工过程中产生的木质废弃物约2.4×107m3,折合标准煤1.5×106吨;各种天然薪材的合理提供量为1.4×109吨,折合标准煤0.7×109吨[19]。截至2015年,我国生物质发电总量约1030万千瓦,其中农林生物质直接燃烧发电约530万千瓦,垃圾焚烧发电约470万千瓦,沼气发电约30万千瓦,生物质发电已基本成熟 [20]。
生物质能作为一种污染小、可循环利用的新型能源,各国在大力推进新能源发展战略时将生物质列为能源领域重要研究方向,并将研究和开发生物质能放在首要位置。我国的生物质资源丰富并且数量巨大。在2007年,对生物质产量的统计数据结果显示,以产能计算,测得中国年产生物质能相当于9.3×109吨标准煤,其中的农林废弃物可提供相当于3.8×109吨标准煤的能量。据统计, 我国农作物秸秆可采集量约为4.5×109吨/年,折合相当于标准煤 1.8×109吨;稻壳5×107吨,折合标准煤2×107吨;林业加工过程中产生的木质废弃物约2.4×107m3,折合标准煤1.5×106吨;各种天然薪材的合理提供量为1.4×109吨,折合标准煤0.7×109吨[19]。截至2015年,我国生物质发电总量约1030万千瓦,其中农林生物质直接燃烧发电约530万千瓦,垃圾焚烧发电约470万千瓦,沼气发电约30万千瓦,生物质发电已基本成熟 [20]。
图1-4 生物质能转化技术
1.5.2生物质的综合利用
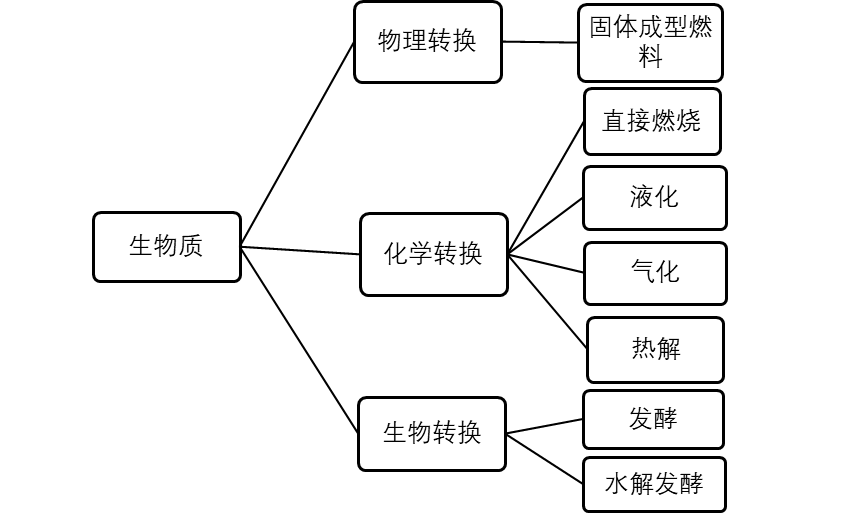
目前生物质资源的综合利用转换方式分为三种:物理转换、化学转换和生物转换。其中涉及到气化、液化、热解、固化和直接燃烧等技术[21]。
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示: