甲烷重整制氢的非贵金属催化剂研究进展毕业论文
2020-02-18 10:43:24
摘 要
氢气作为一种重要的新型绿色能源,它的优点是燃烧热值高,并且水是理论中氢气燃烧后唯一的清洁燃烧产物。而甲烷重整制氢反应是一种高效且经济的制氢方法,其中有甲烷二氧化碳重整制氢,水蒸汽重整制氢,部分氧化制氢和自热重整制氢等四种方法路线。其中,甲烷水蒸汽重整是最常见的应用之一,并且已经在世界范围内大规模工业化,全世界通过该方法产生的氢的一半以上。而通过用二氧化碳重整甲烷来生产氢气有助于减少温室效应,这对于保护环境和资源的可持续发展非常重要。然而,目前用于甲烷重整制氢的技术途径通常具有若干问题,例如催化剂容易积碳失活以及生产成本较高等各种难题。
本文主要综述了国内外的研究学者在最近几年对甲烷重整制氢技术以及非贵金属催化剂的研究进展,其中着重从非贵金属催化剂失活方面介绍最新研究进展和现存的问题,补充了介绍催化剂制备方面的研究进展,并对将来甲烷重整制氢的催化剂发展进行展望。
关键词:甲烷重整制氢;催化剂;积炭;失活;催化剂制备
Abstract
As an important new green energy, hydrogen has the advantages of high calorific value of combustion and water is the only clean combustion product after hydrogen combustion in theory. Methane reforming to produce hydrogen reaction is an efficient and economical method, including methane and carbon dioxide reforming to produce hydrogen, steam reforming to produce hydrogen, partial oxidation to produce hydrogen and self-heating reforming to produce hydrogen. Methane steam reforming is one of the most common applications, and has been widely industrialized worldwide, producing more than half of the world's hydrogen. The production of hydrogen by reforming methane with carbon dioxide can help reduce the greenhouse effect, which is very important for the sustainable development of the environment and resources. However, there are several problems in the current technology of methane reforming to produce hydrogen, such as the catalyst easy carbon deactivation and high production cost.
This paper reviews the research progress of methane reforming hydrogen production technology and non-precious metal catalysts in recent years, which mainly from the aspects of non-noble metal catalyst deactivation introduces the latest research progress and existing problems, and supplementary introduced the progress in research of catalyst preparation and the development of hydrogen production from methane reforming catalysts in the future was discussed.
Keywords: Methane reforming for hydrogen production; The catalyst; Carbon deposition; The deactivation; Catalyst preparation
目 录
第一章 绪论 1
1.1 研究背景 1
1.2 国内外研究现状 2
第二章 甲烷重整制氢技术概述 3
2.1 甲烷水蒸汽重整制氢(SRM) 3
2.2 甲烷二氧化碳重整制氢(DRM) 4
2.3 甲烷部分氧化重整制氢(POM) 5
2.4 甲烷自热重整制氢(ATR) 5
第三章 非贵金属催化剂相关概述 7
3.1 催化剂成分 7
3.1.1 催化剂活性组分 7
3.1.2 催化剂载体 7
3.1.3 催化剂助剂 8
3.2 非贵金属催化剂失活研究进展 8
3.2.1 催化剂积炭 8
3.2.2 催化剂烧结 10
3.2.3 惰性位点 11
3.3 小结 12
第四章 催化剂的制备 13
4.1 主要制备方法概述 13
4.2 介孔Ni-Al2O3催化剂的制备概述 13
第五章 总结与展望 16
5.1 全文总结 16
5.2 工作展望 17
参考文献 18
致谢 21
绪论
研究背景
自化石燃料的使用进入人们的视野,能源问题一直是一个萦绕世界各国的问题。一方面,随着人们经济的迅速发展,对能源的需求一直不断增加。而另一方面我国对环境保护[1~2]的也要求越来越严格,国民对环境的保护意识日益增强,尤其对目前以化石燃料[3]主要能源系统继续提出新的限制措施。化石燃料的储量是有限的,而目前对其的需求依然在不断增长,长久以往下去终将面临化石燃料枯竭这个困状。因此,在本世纪出开发一种新的清洁可再生能源,这在能源领域的发展历程中是重要的一个趋势,氢能就是其中的一种相对较理想能源的代表。
选择氢能[4~5]承当解决未来能源问题和环境危机的一种重要途径,已受到世界各国的广泛关注与热议。在能源分类上,它作为一种有效的二次能源,利用的领域范围极其广泛,如炼油、冶金、食品甚至燃料电池、电子、航天等高精尖化工领域中。氢能是一种重要的绿色新能源,基础能量密度是汽油的3倍[6]。由于其理论燃烧产物是水的缘故,不用担心对环境造成污染。因此,人们对石油等化石能源的需求向氢能源需求转变趋势将会不断变大,氢能源有望成为下一代基础能源。
甲烷这种资源与煤油等化石能源相比,它蕴含丰富且更加洁净。从甲烷的分子式中可以看出,H/C比为4,而在所有烷烃中,这代表甲烷是有着最高的含氢量。甲烷重整是一种经济、高效的制氢[7]方法,如甲烷水蒸汽重整、甲烷二氧化碳重整、甲烷部分氧化重整以及甲烷联合重整等[8~9]。其中,甲烷蒸汽重整是最常见的应用,并已被大规模工业化,通过这种方法约占世界氢的1/2。目前较为成熟的路线是通过甲烷重组生产氢气和一氧化炭,然后转化为重要的化工原料,如烯烃、甲醇、二甲醚、氨等。然而,改造制氢的技术路线面临着投资成本高,工艺过程复杂,以及把生产成本大大提高这些方面的问题。
在甲烷重整制氢[10]中比较关键的部分就是催化剂,而反应多以负载型金属催化剂最为常见,催化剂按金属活性组分可分成贵金属和非贵金属两类。贵金属如Pt、Pd、Ru、Rh催化剂在甲烷重整反应中具有高活性、高稳定性和优异的抗积炭11]性能,但由于贵金属资源稀缺、价格昂贵等特点,限制了其工业化应用前景。非贵金属如Ni、Co、Fe等VШ族过渡金属在甲烷重整反应中表现出较高的初始活性,有研究工作表明通过加入一些非贵金属如Co、Fe等可以提高Ni基催化剂的重整性能,Co或Sn的加入提高了Ni基催化剂的抗积炭能力,大大提高了催化剂的稳定性。因此,制备出高性能的非贵金属催化剂是一个具有巨大吸引力的研究方向。
国内外研究现状
催化剂作为甲烷重整制氢环节中的重要的一环,国内外研究学者纷纷对其展开了大量的实验研究。万子岸等人[12]主要的分析方向是催化剂的活性组分、载体和助剂这些成分对催化剂的活性和稳定性会造成什么影响。结果表明,作为研究者关注的焦点,提高镍的分散性和耐氧性,可以通过添加相应的助剂以及选择更加适合的载体,进而提高了镍基催化剂的活性和稳定性。
贺隽等人[13]主要研究的重点是提高Ni催化剂的催化活性和稳定性可以利用不同的载体,以及提高反应性能可以通过添加合适的助剂来实现。此外他们还综述了甲烷催化重整高性能催化剂的种类、载体和助剂这些催化剂的成分等方面的研究现状。
方修忠[14]从Ni晶粒尺寸控制、Ni与载体间相互作用以及催化剂结构等角度出发,进行对催化剂的研究。他通过采用蒸发诱导自组装法制备了有序介孔Ni-Al2O3催化剂;采用软模板法合成了具有特殊形态和孔隙结构的SiO2载体;以乙二醇作为溶剂采用浸渍法制备出CeNi/m-SiO2催化剂等方法,设计制造不同的高效镍基重整催化剂,以此降低制氢成本。
Nicolas等人[15]对甲烷干重整催化剂进行了设计,对活性金属分散的各种程度相互比较,肯定了催化活性和稳定性在很大程度上取决于活性金属分散。R.M.Navarro等人[16]利用稀土元素Nd、Ce、La改性Ni/SBA-15催化剂,发现这些稀土元素的添加促进了活性金属Ni在SBA-15载体上的分散,活性组分与载体间相互作用得到增强。这使得催化剂在甲烷二氧化碳干气重整中具有更高的活性和稳定性,它的抗积炭性能也明显得到了改善。Sung Hyun Kim等人[17]用碱土金属Ca改性Ni/MgAl2O4催化剂用于重整制氢,结果表明随着Ca元素加入,活性组分Ni与MgAl2O4尖晶石载体间的相互作用增强,有效抑制了Ni活性组分在高温条件下聚集烧结。
由于镍基催化剂易因表面积炭和金属烧结而快速失活,卢君颖等人[18]转而研究了钴基催化剂的重整反应机理以及积炭-消炭过程,对单金属Co基催化剂,金属载量是重要的影响因素,通常选择6%~12%作为最佳载量。对双金属Co基催化剂的关键结构参数是第二金属的选择以及第二金属与Co金属的含量比。含Co的碳化物作为新型的活性相在重整反应中表现出良好的催化性能,但其稳定性有待提高。
Xing Zhu等人[19]通过用浸渍法制备了CeO2-Fe2O3复合氧载体,并用X射线衍射仪(XRD),拉曼光谱和氢程序还原(H2-TPR)表征。得出了在甲烷等温反应中,为了获得具有合适H2/CO摩尔比的合成气并避免甲烷裂解,氧化铈载体的还原程度应控制在低于5%的水平,蒸汽和二氧化铈氧载体之间的水裂解反应可以产生除CO2以外的纯氢气的结论。
Swapnil A等人[20]通过以镍、钴(不同比例为0-40%)和水滑石(HTlc)为原料合成了一种新型混合材料,Ni的蒸汽重整活性与Co的高水汽位移(WGS)能活性互补。而Ce的促进作用导致了CO2吸附的强碱性位点,高比表面积和碱度促进的材料阻碍了焦炭的形成,从而提高了H2的产量。得出了镍、钴混合材料能够对甲烷重整产生氢气有存进作用的结论。
甲烷重整制氢技术概述
甲烷水蒸汽重整制氢(SRM)
甲烷水蒸汽重整[21],作为工业上使用甲烷生产的大规模氢气,它是目前世界上成本最低的技术路线,也是制备清洁能源氢气方式中最重要的一次跳跃。早在19世纪末,甲烷和水蒸汽的重组反应就得到了广泛的关注。直到20世纪上半叶,美国的巴斯夫公司才首次成功地将甲烷蒸汽重组技术应用于工业化。此后各家公司纷纷投入甲烷水蒸气重整制氢的进程中,在距今几十年的发展历程中,催化剂的研究不断加大,生产工艺也随之不断改进与完善。甲烷与水蒸汽反应生成合成气的转化过程也变得越来越成熟。据了解,到目前为止世界上80%以上的氢气都是甲烷与水蒸汽发生重整反应所产生。从化学反应能来看,甲烷水蒸汽重整反应是一个强吸热反应体系,可以产生的合成气中H2/CO约为3,反应包括:
CH4 2H2O=3H2 CO (ΔHθ298K= 206.3KJ/mol) (2.1)
CO H2O=H2 CO2 (ΔHθ298K=-41.2 KJ/mol) (2.2)
CH4 CO2=2H2 2CO (ΔHθ298K= 247KJ/mol) (2.3)
CH4 2H2O=4H2 CO2 (ΔHθ298K= 165KJ/mol) (2.4)
总反应式为:(x 1)H2O CH4=(1-x)CO (x 3)H2 xCO2。甲烷与水蒸汽的重整反应,这个过程中需要吸收大量热量,设定的反应条件通常为温度800~1100℃、压力2.5~3MPa以及水碳比2~4[22],反应可以制得3份体积的H2与1份体积CO的合成气,较高的H2与CO比值是人们青睐这种方法的一种原因。燃气变换反应的反应温度在200~500oC之间,它是一个放热反应。对反应过程进行分析,可以把此过程分为两个阶段,第一阶段在高温阶段(350~500oC),这个阶段完成了主要的转换进程;第二阶段在低温阶段(200~350oC),这个阶段从CO与H2O反应中转化出CO2和额外的H2,从而提高H2产率。合成气中氢气含量很高,因此主要用于合成氨及工业用氢的生产[23]。甲烷水蒸汽重整是一个极为复杂的反应系统,除了上述主要反应外,还有两个会产生积碳的副反应,它们分别是CO歧化反应(Boudouard反应)(2CO=C CO2)与甲烷裂解反应(CH4=C 2H2),下文会对两个反应进行分析。
其基本工艺流程如图2.1,原料气的处理、蒸汽的转化、CO的变换和氢气净化提纯这四个步骤组成全部流程。且通常在负载型镍基催化剂上发生吸热反应,生成富含氢的混合气体。
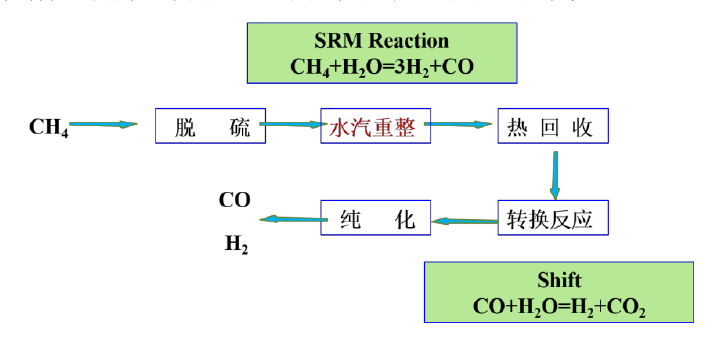
图2.1 SRM反应工艺流程图
甲烷二氧化碳重整制氢(DRM)
作为两种主要的温室效应气体,CH4和CO2同时也被认为是目前全球气候变暖这一严峻环境问题的主要罪魁祸首。因此,如何控制温室气体CO2等的排放,成为各国科学家和政府关注的焦点[24]。甲烷二氧化碳重整反应,又称作甲烷干气重整反应,可以同时转化CO2和CH4两种温室气体,不仅起到积极的对环境保护作用,而且反应中能产生的合成气H2/CO比值约为1,这适合做费托合成的原料气和直接羰基合成[25],可以理解为甲烷的一种有效利用方式,减少其他产物提高了工业生产的效率。甲烷二氧化碳重整制氢的反应过程主要包括如下几个反应:
CH4 CO2=2CO 2H2 (ΔHθ298K= 247KJ/mol) (2.5)
H2 CO2=CO H2O (ΔHθ298K= 41KJ/mol) (2.6)
CH4=C 2H2 (ΔHθ298K= 75KJ/mol) (2.7)
2CO=C CO2 (ΔHθ298K=-172KJ/mol) (2.8)
CO H2=H2O C (ΔHθ298K=-175KJ/mol) (2.9)
甲烷二氧化碳重整制氢的主要反应(2.5)是一个强吸热的反应,倾向于在高温低压的环境下进行,此环境下对正反应的进行有利。从反应平衡数据(表2.1)分析,反应(2.5)、(2.6)、(2.7)的平衡常数,它都是随着温度增加而不断地增大的,说明甲烷二氧化碳重整的主要反应(2.5)和逆水煤气反应(2.6)在反应温度升高的情况下是有利的,根据主反应可以推导出H2与CO在合成气体中的理论比值应该为1,但由于反应(2.6)的存在,H2与CO2一比一反应消耗导致二氧化碳的转化率高于甲烷的转化率,这也就造成了产物中的H2与CO比值小于1。甲烷二氧化碳干气重整反应中产生积炭、导致催化剂失活的重要原因是甲烷裂解反应(2.7)和一氧化碳歧化反应(2.8)这两个反应。从表2.1中可以看出,反应(2.8)的平衡常数是会随着温度增加而不断减小,当反应温度高于800oC时,平衡常数已经低于.0.1,一氧化碳歧化反应(2.8)明显受到了环境的抑制,因此高温下甲烷二氧化碳干气重整反应中产生积炭的主要原因是甲烷裂解反应(2.7)。




